Introduction
[要約]
このページでは、細胞表面、細胞外のタンパク質が糖鎖で化学修飾されていること、ならびに、我々の有機生物化学研究室の目的、研究概要について述べる。
[糖鎖による翻訳(時)後修飾]
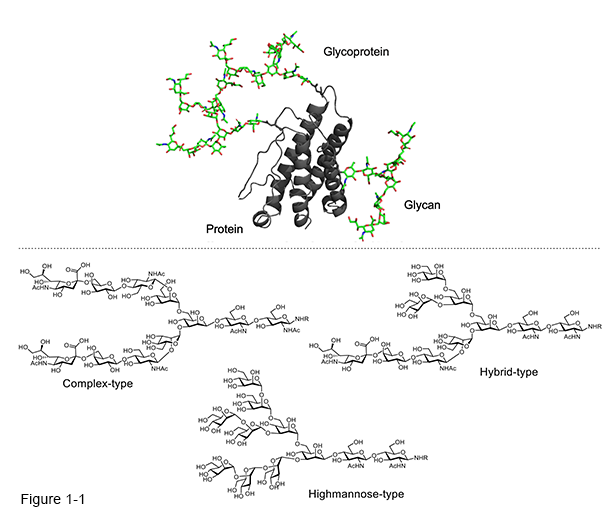
生体システムを理解するためには、タンパク質の翻訳(時)後修飾(Co-/Post Translational Modification: Co-/P-TM)によって、タンパク質の機能がどのように調整されているか調べる必要がある[1]。最近の研究により、これらの修飾が、がん、アルツハイマー病、パーキンソン病などの多くの疾患にも影響していることが明らかになっている[2-5]。これらのタンパク質修飾の中でも、糖鎖修飾は、真核細胞において最も多い化学修飾の一つである。 リボソームは、mRNAに記載されているアミノ酸配列にそってポリペプチドを合成する(mRNAからペプチドに翻訳する)。作られたポリペプチドは、リボソームの出口からでてくるとともに、その2次構造(ヘリックス、ストランド)を取り始め、全長のポリペプチドが合成されるとタンパク質は、3次構造を形成する。このポリペプチドが合成されている最中、すなわち、リボソームからペプチドが出てきた際に化学修飾が起こることを翻訳時修飾という。また、ポリペプチド全長が合成された後(翻訳された後)、化学修飾が起こることを翻訳後修飾という。これら化学修飾は、全て酵素によりおこなわれる。 糖タンパク質は細胞表面や血液などの体液中に存在し、これらのタンパク質はセリン・スレオニン結合型糖鎖(O型糖鎖)やアスパラギン結合型糖鎖(N-型糖鎖)で修飾されている[6]。これに加え、硫酸化された糖鎖も存在する。N型糖鎖付加は小胞体からその生合成が開始される。N型糖鎖は、タンパク質中にあるコンセンサス配列(Asn-Xaa-Ser/Thr;Xaa:Proを除く任意のアミノ酸)のアスパラギン側鎖の窒素原子に翻訳時に結合する。この際の糖鎖は、グルコース3つ、マンノース9つからなる高マンノース型糖鎖が結合する。そして、タンパク質全長が小胞体内で合成されると同時に糖鎖がタンパク質のフォールディングを補助する。正しいタンパク質構造になったものはゴルジ体へと運ばれ、そこで糖加水分解酵素、糖転移酵素により酸性の複合型糖鎖へと変換される。この糖鎖再修飾も翻訳後修飾という。また、ゴルジ体では、O型糖鎖の付加がタンパク質に起こる(翻訳後修飾)。付加位置については、いまだ理由が明らかになっていない。また、ゴルジ体を通ったあとのN型糖鎖はその長さが違ったり(構成糖鎖の数の違いによる)、枝分かれ様式が違うなど、かなりの構造多様性を示すようになる[7]。 (Fig1-1).
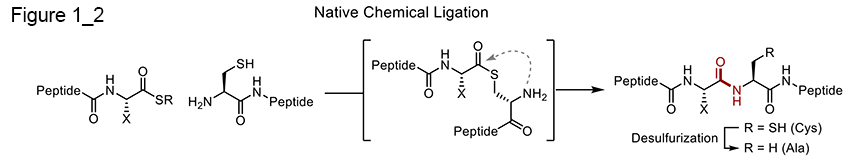
この糖鎖構造の多様性は非常に興味深く、個々の糖鎖構造によって、タンパク質機能が微妙に調整される。すなわち、多様な糖鎖付加パターンは、対応する糖タンパク質の構造や機能の多様性を増大させ、その結果、糖タンパク質の機能はより複雑になる。そのため、糖鎖構造とタンパク質活性の関係を調べることが重要視されている。そこで、有機生物化学研究室の梶原らは、さまざまな単一構造の糖鎖を持つ糖タンパク質の合成法の開発、ならびに、糖鎖機能を調べる研究を2000年頃から開始した。 糖タンパク質の調製は、細胞法が主であったが、前述のように糖鎖構造が多様となり単一構造の糖鎖をもつ糖タンパク質を得ることは困難である。そこで糖タンパク質の化学的全合成が必要となった。基本的な合成法としては、まず糖鎖は全合成ではなく生体試料から単離し利用する(別の項目で述べる)。そして、それら糖鎖を、固相ペプチド合成により糖鎖とペプチドが連結したものを合成する。最後にそれらを順次連結し、目的の全長糖タンパク質を得るという方法を採用している。ペプチドの連結法には、保護されていないペプチド同士を化学選択的に結合させることができる、ネイティブケミカルライゲーション(NCL)を利用している [8-10]。この反応は、ペプチドの末端がチオエステルになったものと、他方のペプチドのN末端がシステイインになったペプチド間で行われ、図のように、チオエステルの特異な転移反応により天然のアミド結合を生成する非常に有用なものである。糖鎖が結合したタンパク質を合成する際は、糖鎖が結合したペプチドを別途チオエステルとして用意しNCLを利用することで実施できる。これら合成法の詳細は次の項目以降で述べる。 (Fig1-2)