糖鎖構造・生合成・糖タンパク質合成
生体内の糖タンパク質の働き
タンパク質は生合成過程において、様々な修飾を受けることで多様な機能を発揮することが知られています。その中でも、タンパク質の糖鎖付加(グリコシル化)は生体内で高頻度におこる翻訳後修飾であり、タンパク質の機能に大きな影響を与えます。一説にはヒト体内のタンパク質の50%以上がグリコシル化されていると言われています。糖鎖はタンパク質の生理活性に深く関わることが知られています。
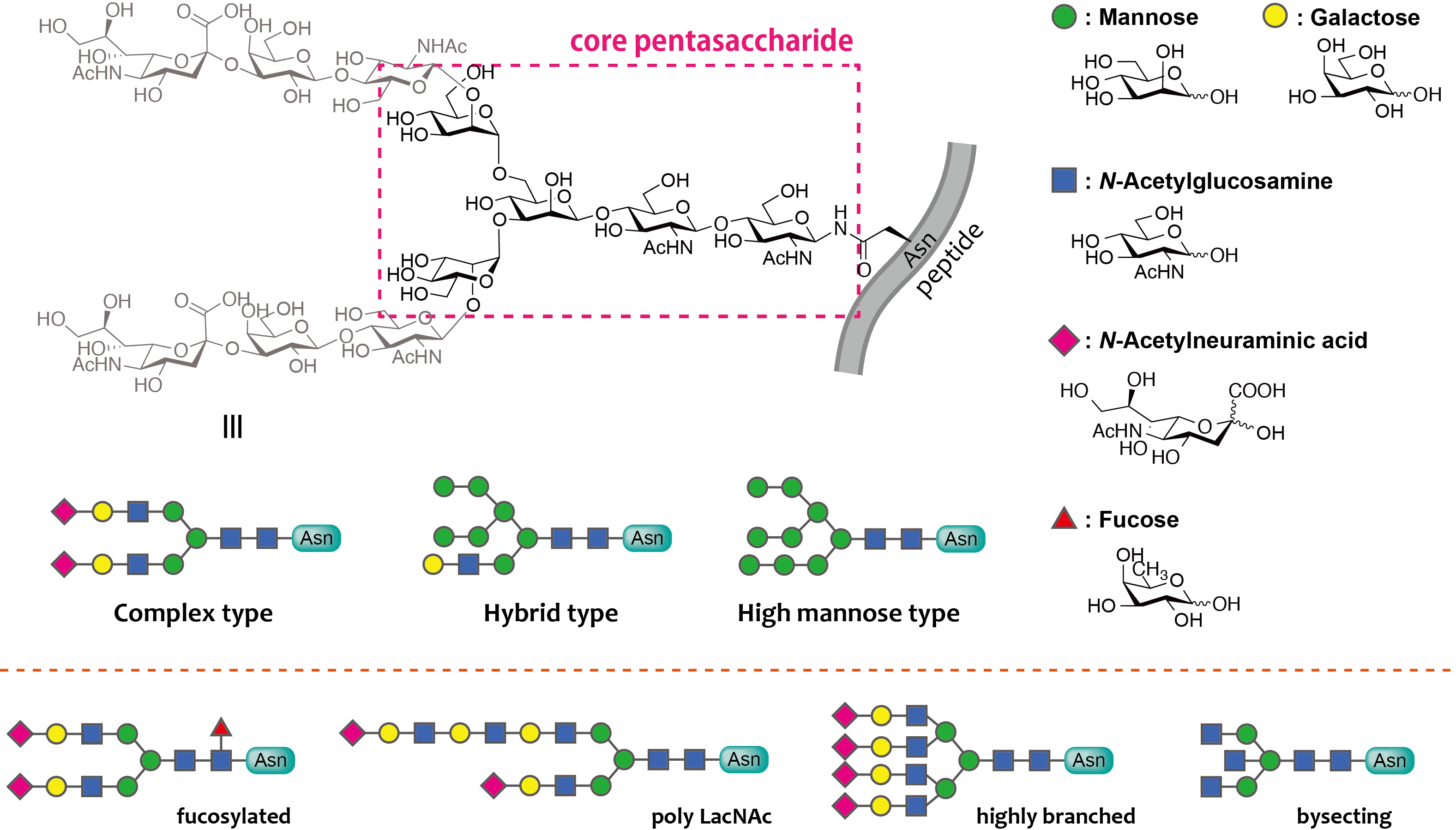
糖鎖構造(ヒト型)
糖とは、6員環骨格に酸素原子を1つ含み、各炭素原子に水酸基が結合したような環状分子で、その水酸基の結合する向き(立体配置)によって名前が決められています(グルコース、ガラクトースなど)。そして、これら糖残基が鎖状に連なったもののことを糖鎖とよびます。生体内に存在する糖鎖は大きく分けて2つに分類できます。脂質との複合体である糖脂質とタンパク質との複合体である糖タンパク質です。さらに、糖タンパク質上の糖鎖には、セリンまたはスレオニン残基の側鎖につながったO結合型糖鎖とアスパラギン残基の側鎖につながったアスパラギン(N)結合型糖鎖があります。

N結合型糖鎖は、さらに高マンノース型(high mannose)、混合型(hybrid)、複合型(complex)糖鎖に分類されます。これら3種類の糖鎖において、アスパラギン残基に近い還元末端側の5糖(コア5糖)は共通となっていますが、非還元末端側の構造にそれぞれ特徴があります。ハイマンノース型糖鎖は非還元末端側が全てマンノースで構成されており、またコンプレックス型糖鎖は非還元末端側にシアル酸、ガラクトース、N-アセチルグルコサミンがあります。そしてハイブリッド型糖鎖はその中間の構造となっています。その中でも、成熟型であるコンプレックス型糖鎖は特に構造的多様性に富んでいます。2分枝型、3分枝型といった分枝度の違い、非還元末端側のシアル酸の有無、還元末端のグルコサミンにフコースがつながったコアフコース構造、そして非還元末端のガラクトースとグルコサミンが繰り返したポリラクトサミン構造などが挙げられます。このように生体内で糖鎖は僅かな構造の違いを持って存在しており、これをグリコフォームとよびます。長年に渡って多くの研究者たちがこのグリコフォームの謎を解き明かそうと研究に励んできましたが、未だに分かっていない部分が多いのが現状です。
N結合型糖鎖を持つ糖タンパク質の生合成経路
これまでに述べてきたように糖タンパク質は、生体内で重要な働きをしています。ここではハイマンノース型糖鎖を使って、巧妙に制御された、その生合成経路の一部を簡単に紹介します。
糖タンパク質の生合成において重要な過程である、タンパク質部分の三次元構造への折りたたみ(フォールディング)は、核に隣接された小胞体(Endoplasmic Reticulum)でおこなわれます。この際、糖鎖構造のわずかな違いが目印となって、次にどのステップに進むかが決められています。その糖鎖構造に着目して各ステップをみていきます。
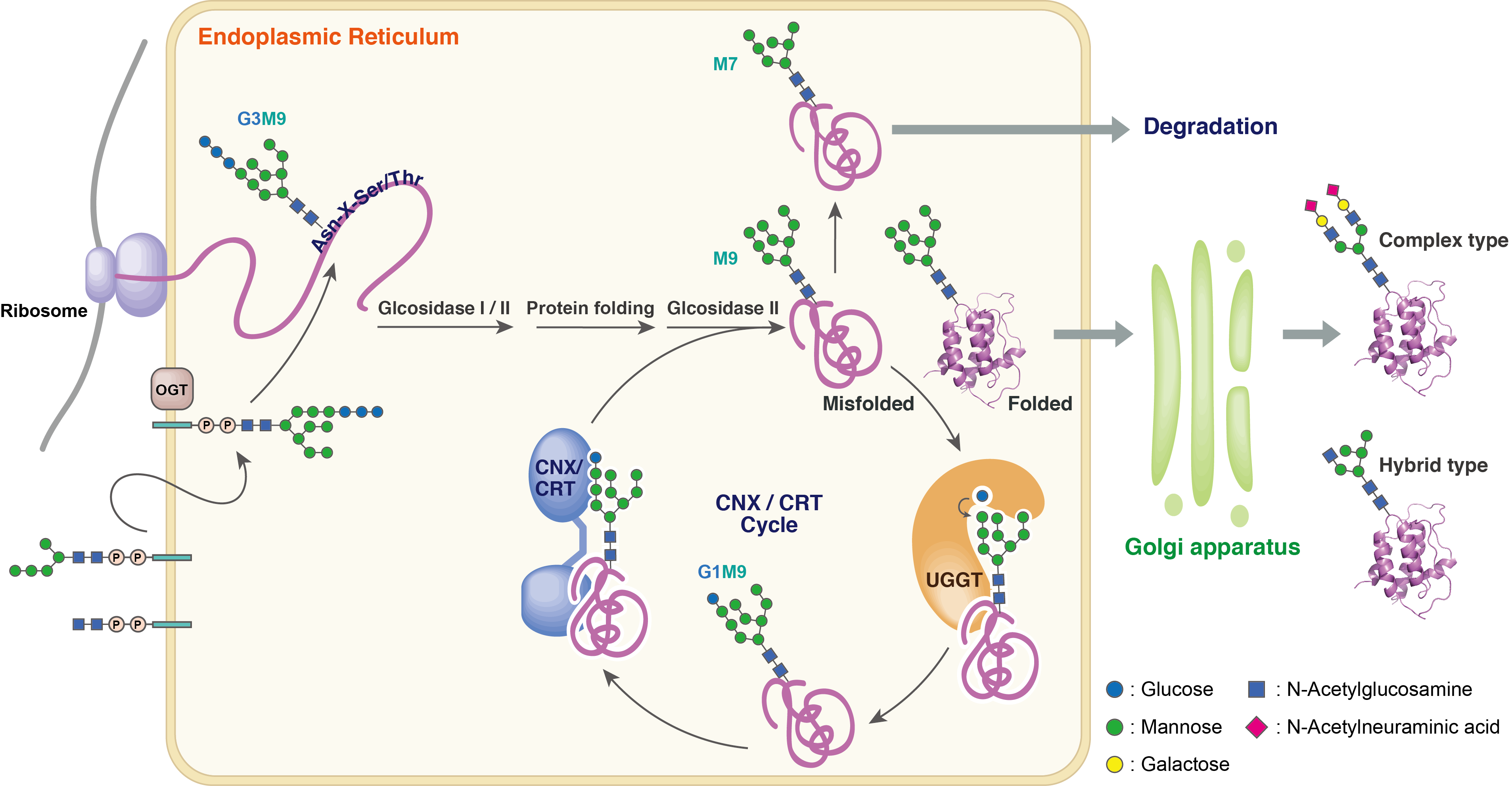
↓ GlucosidaseⅠ, Ⅱ
G1M9型糖鎖(フォールディングを助けるタンパク質であるCNX/CRTなどのシャペロンに特異的に認識され、フォールディングがおこなわれます。)
↓ GlucosidaseⅡ
M9型糖鎖(*この時点で正しくフォールディングしていれば、次の段階である、ゴルジ体へ輸送されていきます。正しい三次元構造をとれていない場合、UGGTというフォールディングセンサー酵素に捕らえられ、グルコースが一つ再付加されます(G1M9に戻る)。また、修復不可能と判断された場合は分解経路へと送られます(M7へ)。)
↓ Mannosidase
M7型糖鎖(分解がおこなわれるサイトゾル(小胞体の外)への輸送を担うタンパク質に認識され、分解されていきます。)
*正しくフォールディングした糖タンパク質は、ゴルジ体内でさらなる修飾を受け、コンプレックス型糖鎖やハイブリット型糖鎖へと変換されます。これらを終え、完成した糖タンパク質はそれらが働く場である細胞膜や細胞外へと輸送されていきます。
不良品であるミスフォールド糖タンパク質を修復、または分解することで、誤って次の過程に輸送されてしまうことを防ぐこの機構は、工場に例えて、'糖タンパク質の品質管理機構'と呼ばれています。この機構の分子レベルでのメカニズムはまだまだ不明な点も多く、世界中で研究が進められています。当研究室では、後に述べますように、明確な糖鎖構造を持つ糖タンパク質を調製できるという強みを活かして、このメカニズムの解明を進めています。
糖タンパク質の生理機能解明をおこなうには、均一な糖鎖を持つ糖タンパク質の調製が必要です。しかし、我々の体の中でこれら糖タンパク質の糖鎖部分は多様であり不均一です。生体システムを用いた調製方法(動物細胞による発現法など)により得られる糖タンパク質は、糖鎖部分が不均一な混ざり物であり、また得られる量も非常に少ないことが未だ問題として残っています。そのため、糖鎖構造とその糖タンパク質の生理活性相関関係を研究することは困難でした。研究室では、純度の高い糖鎖を予め調製し、これを化学合成に用いることで、均一な構造を有する高純度の糖タンパク質または、糖ペプチドの合成研究をおこなっています。
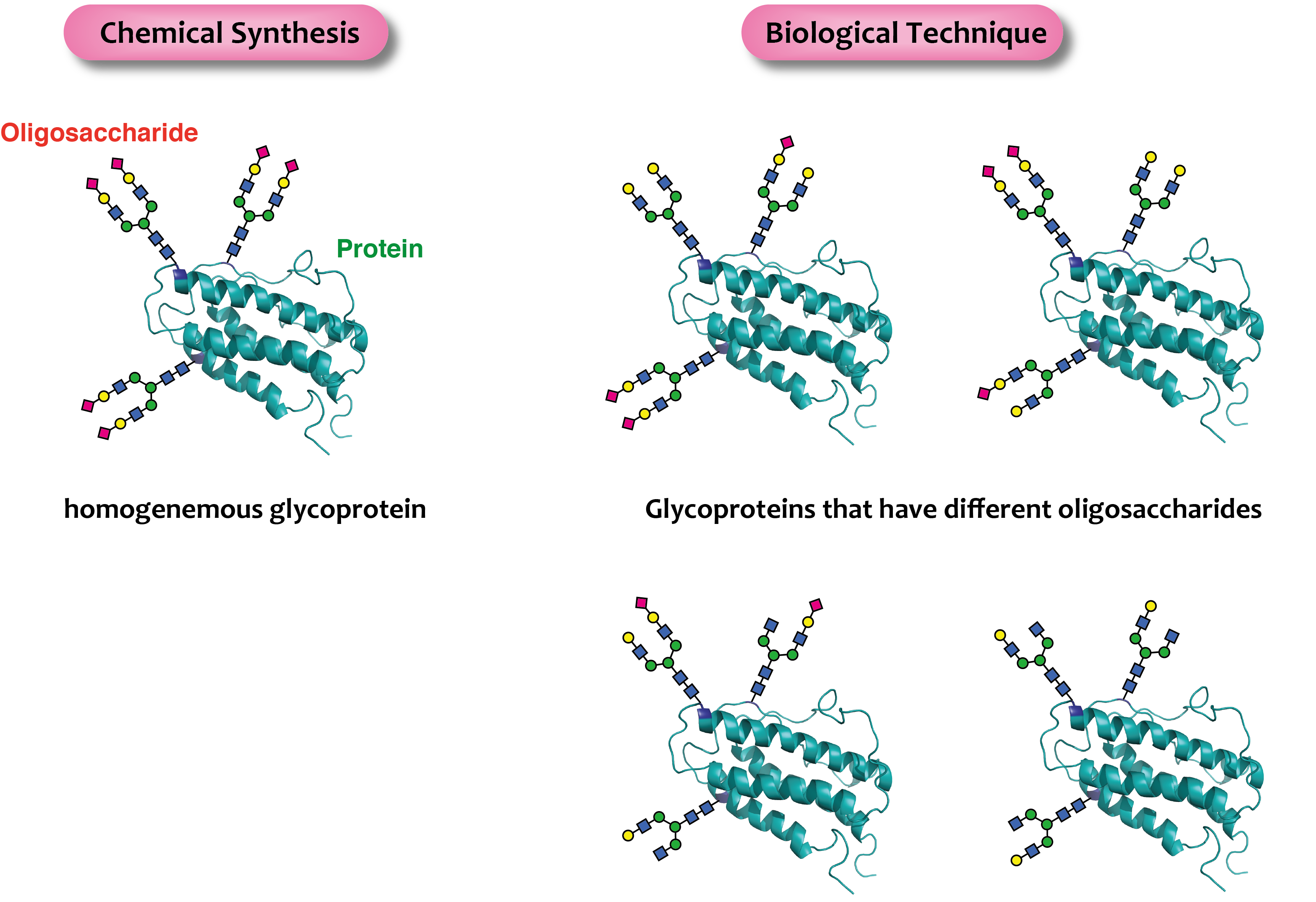
糖鎖がタンパク質の構造や生理活性に深く関わることは数多く報告されています。例えば、赤血球を増殖させる糖タンパク質ホルモンであるエリスロポエチン(EPO)は、結合する複合型糖鎖の本数に依存して赤血球増殖活性が増加することが知られています。また、ヒトIgG抗体はFc部に複合型糖鎖を有しており、その糖鎖構造の違いによって抗体依存性細胞傷害活性に大きな差があることが知られている。これらEPO、ヒトIgG抗体に加え、抗がん治療にもちいられているインターフェロンβ等、幾つかの糖タンパク質は医薬品としても市販されており、その活性発現には糖鎖の付加が不可欠です。
タンパク質の化学合成、NCL、アミノ酸誘導体
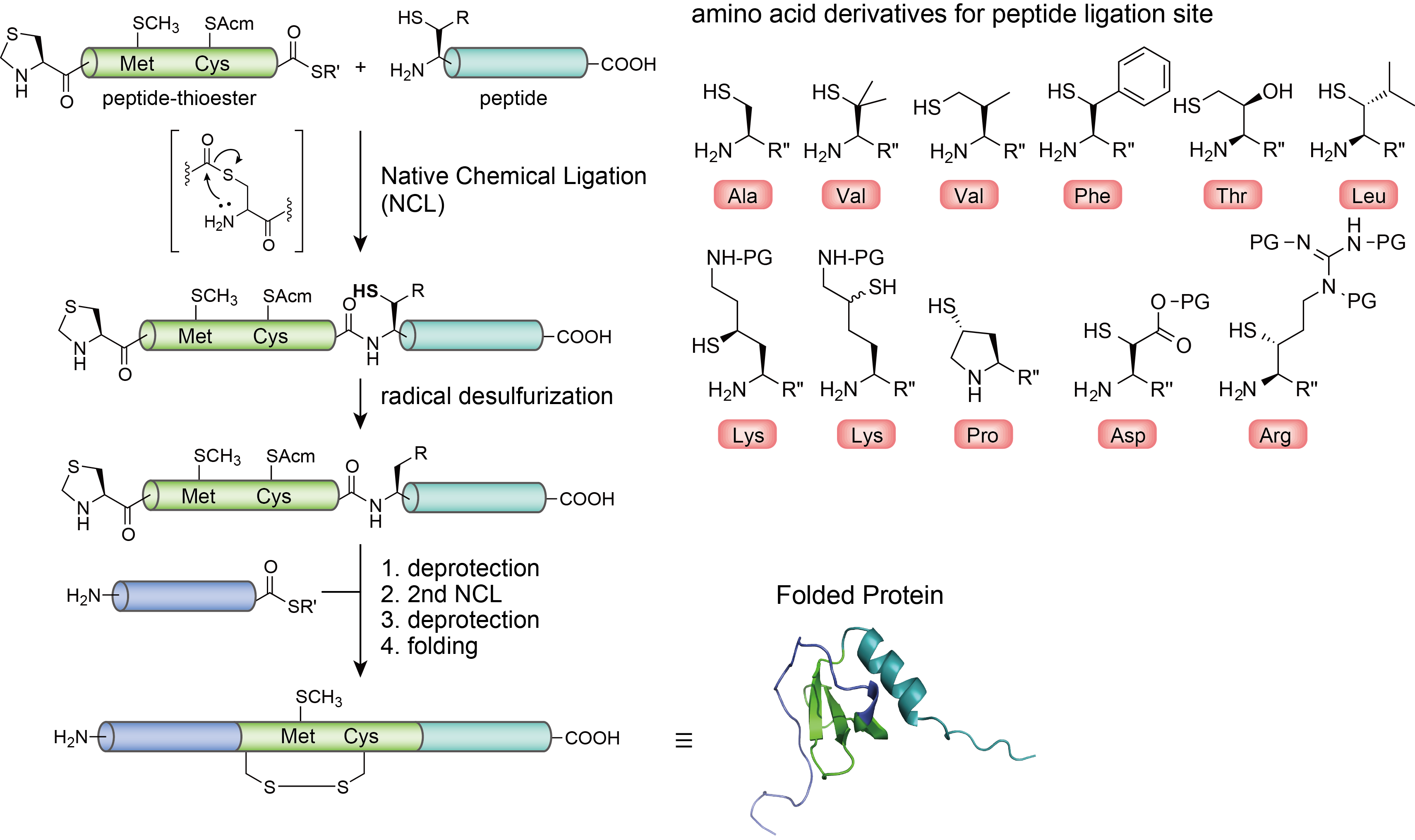
化学合成によってタンパク質を合成する際、アミノ酸を一つずつ、順次連結させることで合成します。しかしタンパク質をひとつなぎに合成することは困難であるため、全長をいくつかのセグメント鎖に分け、それらを連結して構築するのが一般的です。連結にはネイティブケミカルライゲーション(NCL)という反応を用います。(左図 上)この反応はC末端がチオエステルのペプチドとN末端にシステインを持つペプチドが分子内転移を経て天然の結合様式で連結します。そのため、システインの数が少ない、もしくは持たないタンパク質を調製することは難しくなる場合があります。 この問題を克服するために脱硫を用いた方法があります。(左図 中) チオールはラジカル反応により脱硫させることができるという性質から、システインと同様にチオールを持つ他のアミノ酸誘導体(右図)を別途、化学合成により調製し、ペプチドのN末端に用いることでシステイン以外の位置での連結が可能になります。またチオールに保護基を導入しておけばこの脱硫は起こらないため、天然の位置のシステインを保持することも可能です。(左図 下)そして最後に得られたポリペプチドをフォールディングさせることによって、目的とする三次構造をもつタンパク質を得ることができます。(下図) 非天然のアミノ酸を導入することで天然型、非天然型に関わらずターゲットタンパク質を合成することが出来るため、当研究室では様々なアミノ酸誘導体合成も展開しています。
複雑な糖鎖の調製法
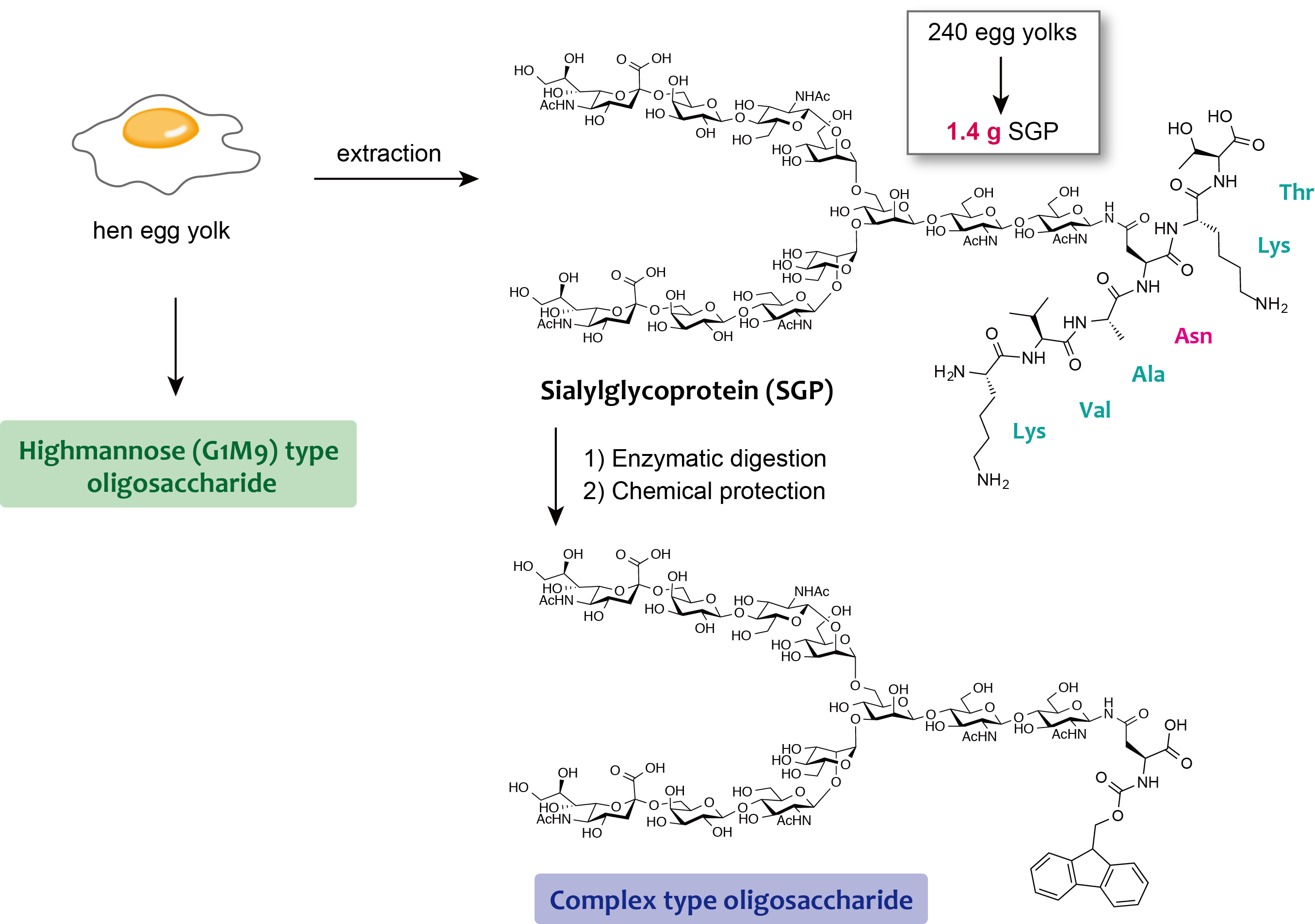
糖鎖の機能を解明するためには、高純度の糖鎖が必要となりますが、糖鎖を化学的に調整するには非常に高度な技術が要求されます。そこで当研究室では、N結合型糖鎖が大量に含まれる鶏卵の卵黄から、酵素を用いた手法と化学な手法とを組み合わせることによってグラムスケールでの高純度なN結合型糖鎖を得ることに成功しています。まず、卵黄よりアスパラギン残基の側鎖に糖鎖が付加した数残基からなる糖ペプチドを単離します。続いてプロテアーゼ(プロナーゼ)によりアスパラギン残基以外のアミノ酸を消化し、またアスパラギン残基の主鎖に保護基を導入して化学合成に使える形にします。このような方法を用いてハイマンノース型糖鎖やコンプレックス型糖鎖を高純度で、かつ大量に調整しています。
糖ペプチドの調製法
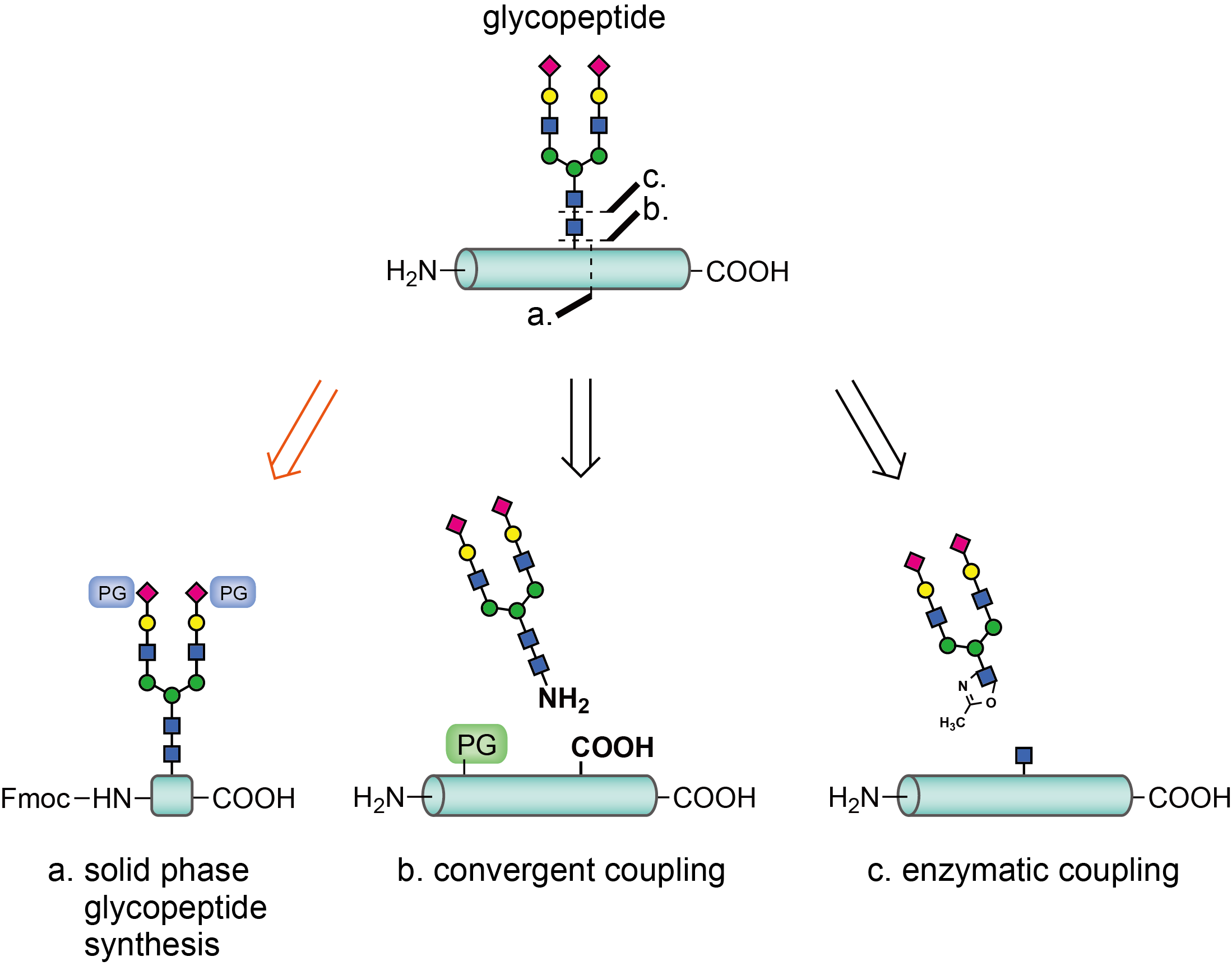
調製した複雑なN結合型糖鎖を組み込み、N結合型糖ポリペプチド鎖を得る方法は大きく3つあります。
aでは、1998年にKlaus Bockらによって開発された方法で、糖鎖の還元末端にアスパラギン残基がついたものを、他のアミノ酸と一緒に固相状に伸長します。この方法は短い 糖ペプチドを合成し、他のペプチドと連結することにより糖タンパク質を合成するので、とても幅広く応用することができます。
bでは、1990年にPeter T.Lansbury,Jrらによって開発された方法で、糖鎖を導入したいカルボキシル基を選択的に遊離することにより、グリコシルアミンとのカップリングを行います。この方法は固相でも液相でも行うことができ、長鎖のペプチドに応用することができます。
cでは、1998年に山本らによって開発された方法で、上記二つの化学的合成とは
異なり、酵素を用いて糖鎖を結合させます。末端にオキサゾリン骨 格を持つ 複
合糖鎖をペプチド鎖上のGlcNacに結合させる方法で、近年正田、L.-X. Wang, Antony J. Fairbanks, Ben G. Davisらによって様々な糖タンパク質が合成されています。
当研究室では大型糖鎖を有するアスパラギンをaの固相合成を用いた方法で組み込み、糖ペプチド鎖を得ています。
シアリル糖ペプチドチオエステル調製
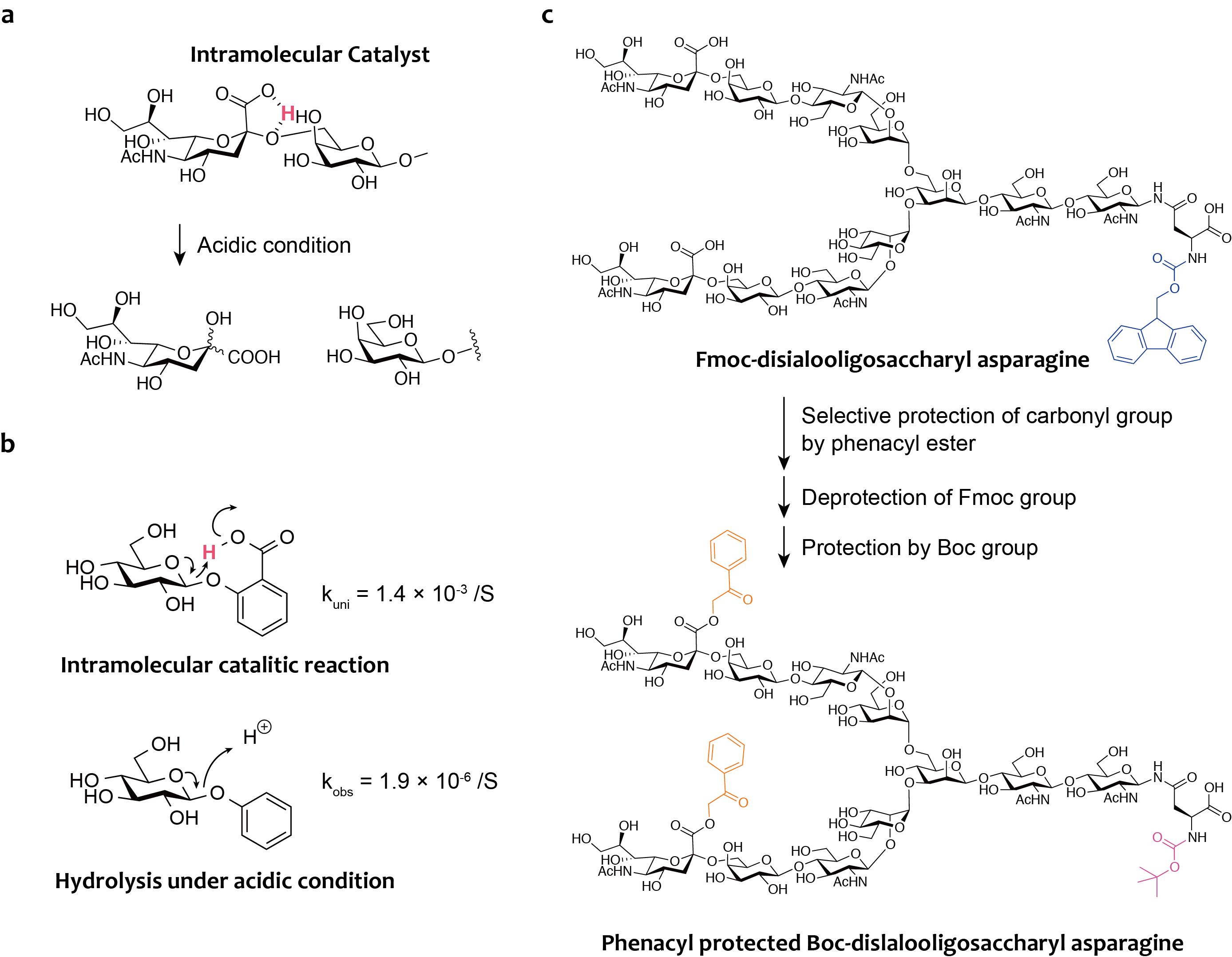
EPOやインターフェロンβなどの生理活性糖タンパク質は、シアル酸を末端に有した糖鎖(シアリル糖鎖)が結合した状態で機能発現することが知られており、シアリル糖鎖を有した糖タンパク質の合成法の確立は非常に重要なものでした。ですが、シアル酸と他の糖残基との結合であるシアリル結合は酸性条件下で容易に分解されることが知られていました。
我々は、その原因がシアル酸のカルボキシル基の水素が、図8-aのように分子内触媒として働くことが不安定性の原因であると考えました。これは、図8-bの1963年に報告されていたグルコース誘導体の加水分解速度を比較した際に、分子内に触媒水素を持つ化合物が非常に早い加水分解を受けたことからヒントを得ました。そこで、図8-cのルートで、Fmocシアリル複合型糖鎖アスパラギンを原料に、シアル酸のカルボン酸をフェナシル基で保護し、また、ペプチド合成の際に必要な保護基であるBoc基を主鎖アミノ基に導入した糖鎖を有機合成で得ました。
得られたフェナシル基で保護された糖鎖は、強酸性条件下(TFA、TfOH)でもシアル酸部分が分解されず安定に存在することがわかりました。
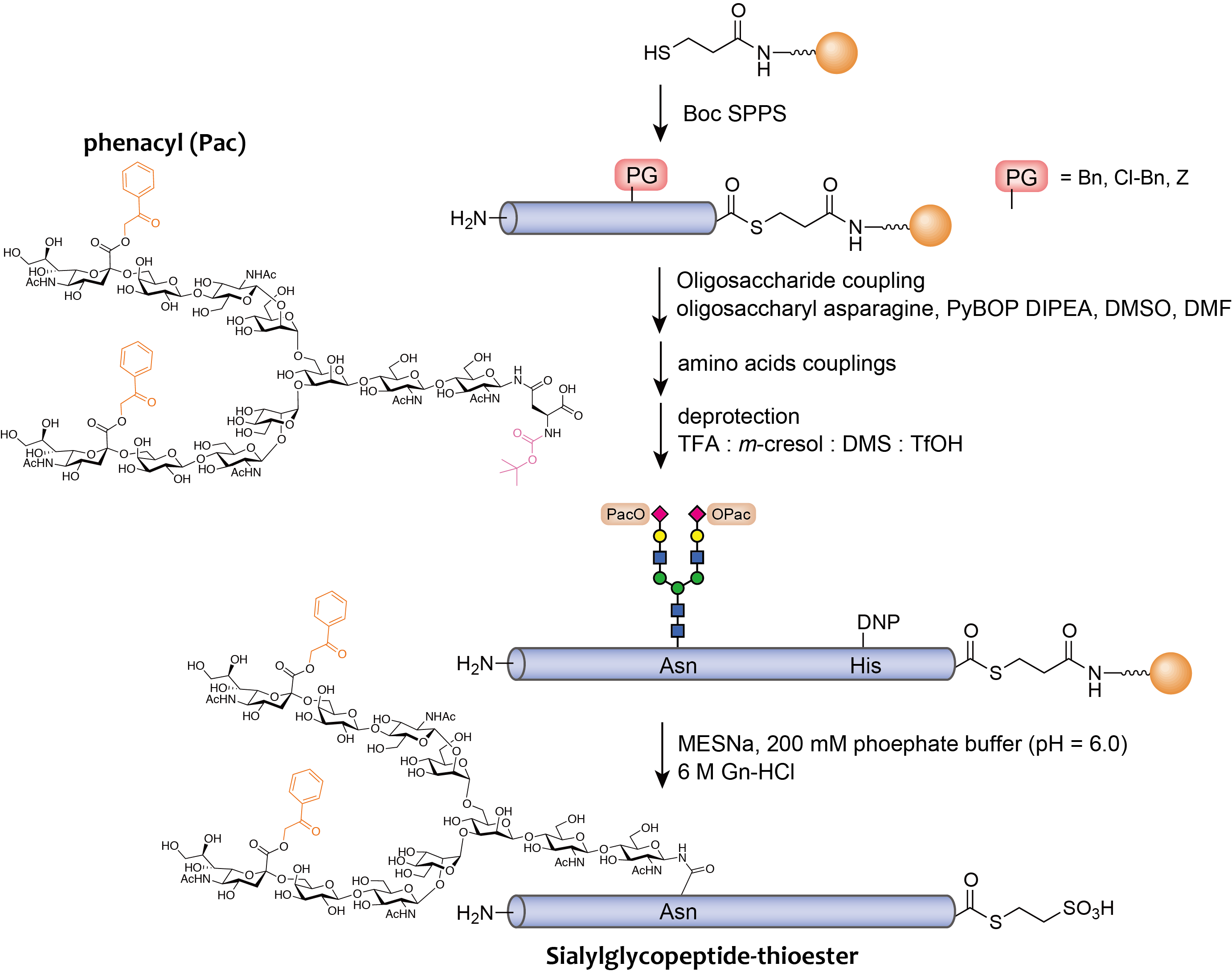
この酸性条件下で安定に存在できる糖鎖を用いて、シアリル糖ペプチドチオエステル体の合成手法を見出しました。この新しい合成法では、まずチオール基を連結させた固相(樹脂)に対して、一般的なBocペプチド固相合成法の条件にてペプチド鎖の伸長をおこないました。この合成の途中で、図8-cのルートで合成したフェナシル基で保護された糖鎖アスパラギン誘導体を縮合反応に用いることで、目的とするアミノ酸配列を有するシアリル糖ペプチドチオエステル体を固相上に構築します。この後、氷冷下でTfOHを含む酸性溶液によりペプチドの側鎖の脱保護をおこないます。この際、側鎖が遊離となったシアリル糖ペプチドチオエステル体は、固相とアミド結合で連結されているため、酸加水分解されずに固相上に残ることになります。よって、この手法では脱保護反応に用いたTfOH溶液や脱保護されたペプチド側鎖の保護基は、溶媒で洗浄するだけで除去することができ、用いた酸等の留去が不要になるため、安全且つ簡便な合成が可能となりました。脱保護反応後は、アルキルチオールを含むリン酸緩衝溶媒下、チオエステル交換によるシアリル糖ペプチドチオエステル体を固相から遊離させ、目的化合物を得ることができるようになりました。
この手法が確立したことで、糖タンパク質合成に欠かせない糖ペプチドチオエステルを得ることができるようになりました。2012年にはこの手法を用いて、2分枝シアリル糖鎖を持つ糖タンパク質EPOの合成に成功しております。
IFN-β(糖タンパク質合成例)

また、当研究室と糖鎖工学研究所との共同研究によりFmoc固相合成法を用いたシアリル糖タンパク質(インターフェロンベータ;IFN-β)の合成に成功しております。
IFN-βは、抗ウイルス作用を持つ、サイトカインの一種です。166残基のアミノ酸からなり、80番目のアスパラギン残基にN結合型糖鎖を有しています。
IFN-βの全合成を行うために、全長をN末端のペプチドセグメント(1-67)、末端のシアル酸にベンジル保護を有する糖鎖を持つシアリル糖ペプチドセグメント(68-88)、C末端のペプチドセグメント(89-166)の3つのセグメントに分け、各セグメントをFmoc固相合成法によって調整しました。
各セグメントをNCLによって連結後、連結部位の脱硫化を行います。システイン残基のAcm基の脱保護と、シアル酸のベンジル基の脱保護を行った後、フォールディング操作を行い、シアリル糖タンパク質IFN-βを得ることに成功しました。
この化学合成によって得られた糖タンパク質IFN-βは、in vivoにおいて活性を示しました。
これは、化学合成によって得られた糖タンパク質がin vivoでの活性を示した初めての例です。
ハイマンノース型糖鎖を持つIL-8を用いた解析
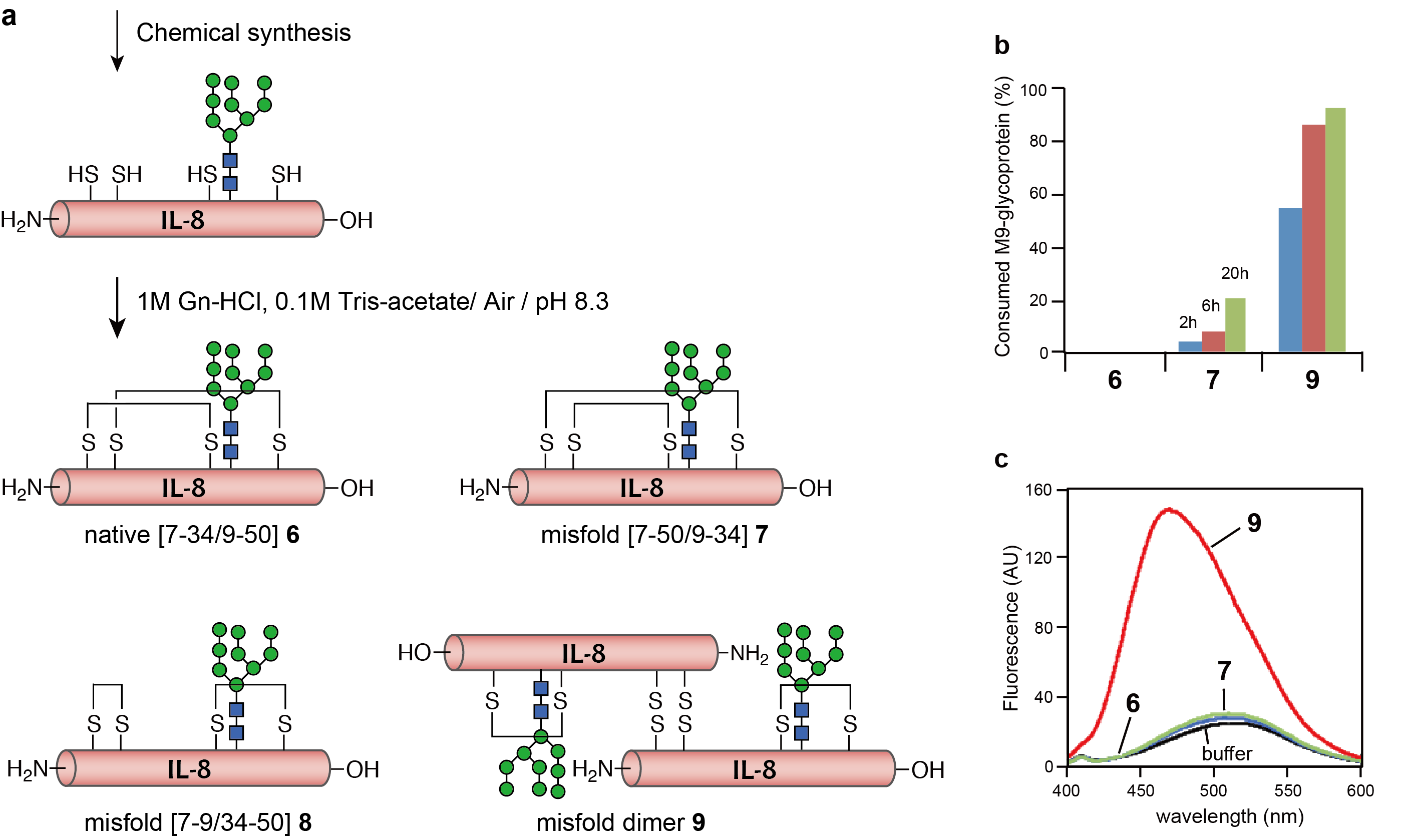
糖タンパク質品質管理機構を調べるためには、ミスフォールド糖タンパク質プローブが必要です。私たちの研究室では、M9-Interleukin 8という糖タンパク質を用いて、天然型の立体構造を持つ糖タンパク質(ネイティブ体,6)とジスルフィド結合のかけ違いによる天然型の立体構造をとれていない糖タンパク質(ミスフォールド体,7, 8, 9)の合成に成功しています
。
(a) これら4種類の糖タンパク質を用いて、フォールディングセンサーであるUGGTによるグルコース転移を調べました。(b) (b)のグラフより、ネイティブ体6はUGGTによるグルコース転移は見られず、ミスフォールド体7, 9は転移がみられることから、UGGTは天然型の糖タンパク質の構造とそうでない構造を識別していることがわかります。さらに、ミスフォールド体7, 9の間でもグルコース転移量に差があることから、ミスフォールド体の構造も識別していることが新たに明らかになりました。ミスフォールド体のそれぞれの構造は、ANSというタンパク質の疎水性表面を認識する蛍光物質により、糖タンパク質の疎水性表面の露出とUGGTの認識が関連している可能性が示唆されました。私たちは、このように構造の違う糖タンパク質を用いて、品質管理機構に関わる酵素の分子レベルでの認識機構解明を目指しています。