
概要
私たちの研究室では,X線回折法を主体に各種手法を用いて高分子物質の分子レベルの構造・構造変化・構造形成過程を解析し,相互作用や機能との関係を研究しています。
対象物質として,生体中の分子モーターや関連する蛋白分子,酸化酵素,合成高分子,それらのモデル化合物,高分子と低分子化合物の複合体などを扱っています。
細菌べん毛モーターと関連する蛋白分子の構造解析
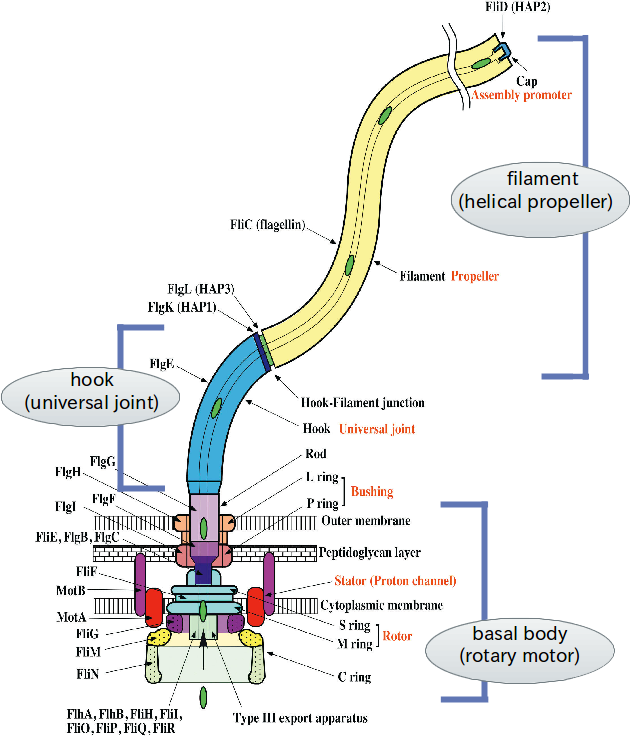 べん毛は細菌が体表に持つ太さ20ナノメートル・長さが約10マイクロメートルのねじれた繊維で,根元にある回転モーターが回ることで推進力を得る運動器官である。回転モーター部分は基部体,らせん型プロペラとして働く長い繊維部分はフィラメント,基部体の回転軸(ロッド)とフィラメントをつなぐユニバーサルジョイント部分はフックと称される。これらは多数のタンパク質から構成される超分子ナノマシンである。
べん毛は細菌が体表に持つ太さ20ナノメートル・長さが約10マイクロメートルのねじれた繊維で,根元にある回転モーターが回ることで推進力を得る運動器官である。回転モーター部分は基部体,らせん型プロペラとして働く長い繊維部分はフィラメント,基部体の回転軸(ロッド)とフィラメントをつなぐユニバーサルジョイント部分はフックと称される。これらは多数のタンパク質から構成される超分子ナノマシンである。
基部体はタンパク質の複合体が集合して形成されているが,いくつかのタンパク質や複合体は他の用途に使われているタンパク複合体と構造が酷似していることが分かっている。そのため,一つの複合体の構造を解明することで,類似の複合体の構造・機能の情報が得られることが期待され,世界中で構造解析が競われている。
べん毛の回転モーターは細胞内外のイオンの透過に共役した電気化学的ポテンシャルを運動エネルギーに変換することで回転する。基部体を囲む固定子内部のチャンネルをイオンが流れるときに基部体との相互作用でトルクが発生するとされている。構成するタンパク質およびそれらがどのように集合しているかは,非常におおまかには解明されているが,細かい構造と機能は不明な部分が多い。このモーターがどのように働いているのか分子の構造を元に追っている。
細菌べん毛の構造形成の機構
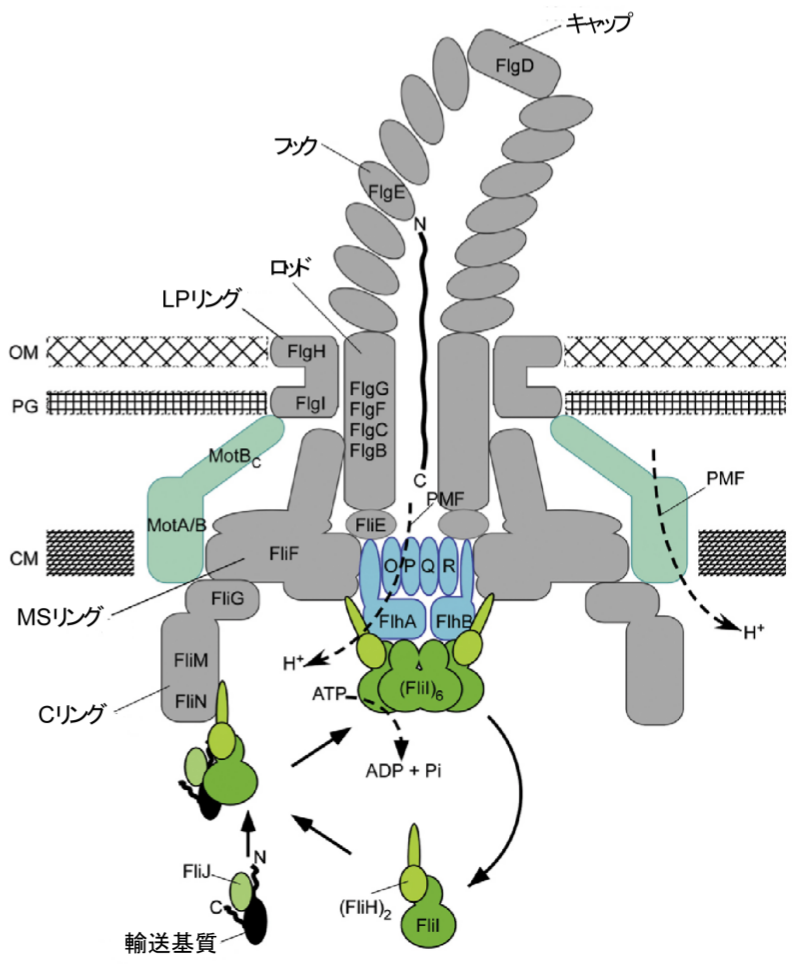 べん毛の形成過程では,まず基部体が形成され,その後中心のモーターの軸部分からべん毛の中空部分を通って送りだされたタンパク質がべん毛の先端部分で構造形成して伸びていく。このとき水溶性タンパク質がべん毛等を形成する部品となるタンパク質を基部体に運び,基部体中央の輸送ゲートのタンパク質が中央の管へと部品となるタンパク質をほどいた状態で送り込むと考えられている。この構造形成過程で実際にどのタンパク質がどんな形態でどのように働いているのかを追っている。
べん毛の形成過程では,まず基部体が形成され,その後中心のモーターの軸部分からべん毛の中空部分を通って送りだされたタンパク質がべん毛の先端部分で構造形成して伸びていく。このとき水溶性タンパク質がべん毛等を形成する部品となるタンパク質を基部体に運び,基部体中央の輸送ゲートのタンパク質が中央の管へと部品となるタンパク質をほどいた状態で送り込むと考えられている。この構造形成過程で実際にどのタンパク質がどんな形態でどのように働いているのかを追っている。
細菌の感染装置
 ①III型分泌系
①III型分泌系
病原性細菌は「III型分泌装置」と呼ばれる器官を用いてエフェクタータンパク質と呼ばれる病原因子を宿主細胞へ送り込み,生理機能を乗っ取って感染する。べん毛の輸送装置は,この病原性細菌の持つ注射器と構造が非常に良く似ており,III型分泌系に分類され,起源を共にしていると考えられている。このため,べん毛の輸送装置・機構に関わる構造を解くことにより,病原性細菌の感染を予防する手段の開発に繋がることが期待される。
②IV型分泌系
IV型分泌系はプラスミドの接合伝達系と起源を共にするタンパク質・核酸の輸送系である。IV型分泌系は,
1.タンパク質だけでなく核酸を輸送するものがある
2.基質が細胞質内にあるとは限らず,ペリプラズムにあるものもある
3.百日咳毒素のようなタンパク質複合体を輸送するものがある
など多彩な輸送活性を持つ。
べん毛と起源を共にするIII型分泌系とは明らかに異なった作動原理を持ち,詳細な構造と機能の解明が待たれている。
走化性受容体
細菌が周囲の特定の化学物質の濃度勾配に対して方向性を持って泳ぐ性質を走化性と呼ぶ。この運動のためには周囲の環境を感知するためのセンサーとなる器官が必要であり,これを走化性受容体と呼ぶ。例えばコレラ菌は胆汁に向かって泳ぐことが知られており,40種類を超える受容体が知られている。受容体からのシグナルをもとに,以下の回転方向の制御をすることにより菌は望む方向へ泳ぐ。
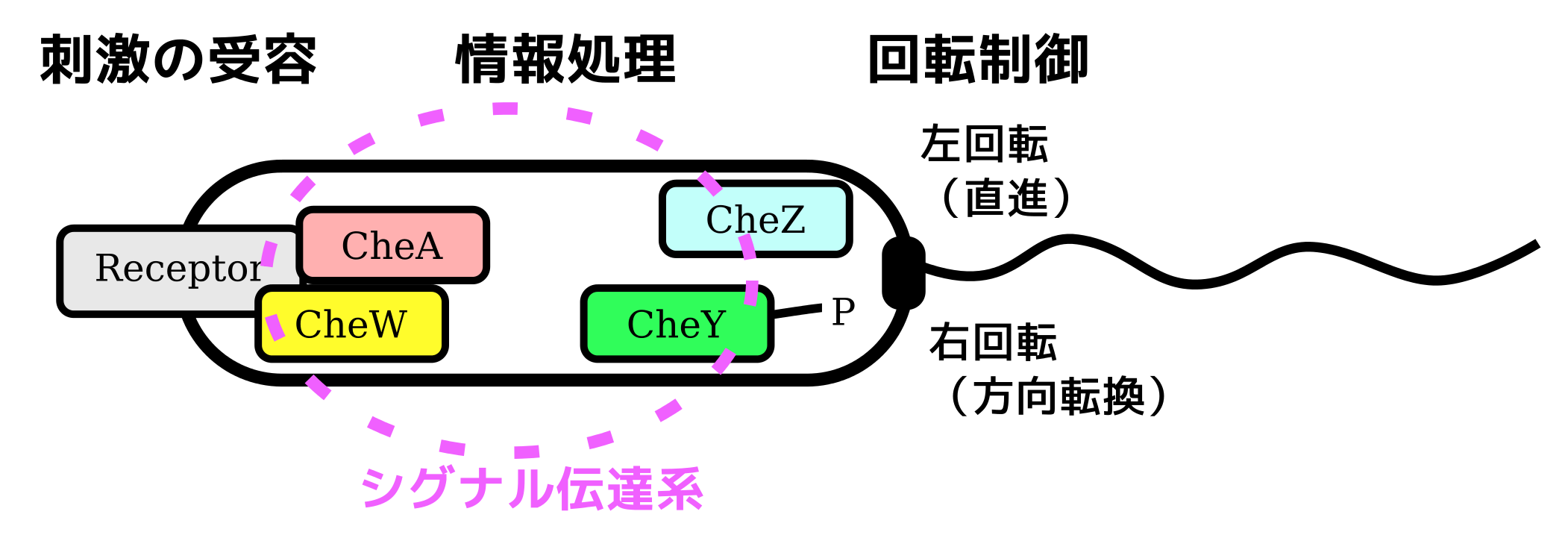
・べん毛が反時計回りに回転して直線的に泳ぐ
・べん毛が時計回りに回転して菌の方向が変わる
我々は,コレラ菌が胆汁に多く含まれるタウリンを受容体のMlp37で認識する仕組みを明らかにした。Mlp37とタウリンやセリン等が結合した状態でX線結晶構造解析を行い,
1.タウリンはセリンと同じ場所で同じ配置で結合する
2.結合するアミノ酸の側鎖がくる位置に隙間がある
ことを見出した。側鎖部分の位置に余裕があるためにMlp37が様々なアミノ酸を認識することができると考えられる。
アミノ酸酸化酵素
酵素は主にタンパク質から構成される生体触媒である。
近年、酵素の持つ特徴を利用したバイオセンサーの研究が盛んに行われている。
酵素の持つ基質特異性を利用して特定の物質の定量、検出を行うことが可能であり、
自然の生物種に存在する酵素に変異を入れることで、元と異なる基質特異性を持つ酵素を創成することも可能である。
様々な基質特異性を持つアミノ酸酸化酵素のX線結晶構造解析を行い、原子レベルでの基質特異性の決定メカニズムを明らかにしている。
蛍光タンパク質
 蛍光タンパク質を用いた生体分子標識技術は,生体内の分子の濃度や分布を調べるためには今や必要不可欠となっている。蛍光タンパク質として有名なのはオワンクラゲ由来の緑色蛍光タンパク質(GFP)であるが,GFPの変異体の1つが黄色蛍光タンパク質YFPである。YFPはGFPの203番目のトレオニン(Thr)をチロシン(Tyr)に置換した変異体で,発色団とこのTyrとのπ-π stackingで安定化され,GFPより長波長側の蛍光を発していると考えらる。YFPはハロゲン化物イオンセンサーや,他の蛍光タンパク質と組み合わせたFRETセンサーなどとして広く使われている。我々は黄色蛍光タンパク質YFPの変異体を用いて新たなセンサーの研究を進めている。
蛍光タンパク質を用いた生体分子標識技術は,生体内の分子の濃度や分布を調べるためには今や必要不可欠となっている。蛍光タンパク質として有名なのはオワンクラゲ由来の緑色蛍光タンパク質(GFP)であるが,GFPの変異体の1つが黄色蛍光タンパク質YFPである。YFPはGFPの203番目のトレオニン(Thr)をチロシン(Tyr)に置換した変異体で,発色団とこのTyrとのπ-π stackingで安定化され,GFPより長波長側の蛍光を発していると考えらる。YFPはハロゲン化物イオンセンサーや,他の蛍光タンパク質と組み合わせたFRETセンサーなどとして広く使われている。我々は黄色蛍光タンパク質YFPの変異体を用いて新たなセンサーの研究を進めている。
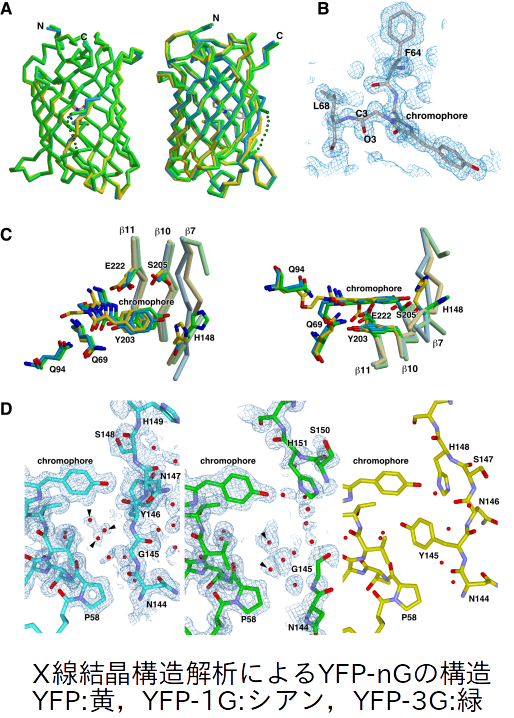
YFPのAsn144とTyr145の間にグリシン(Gly)を挿入すると圧力センサーとして働くことがわかった。YFP,YFPのAsn144とTyr145の間にGlyを1つ挿入したもの(YFP-1G),Glyの3連鎖を挿入したもの(YFP-3G)の構造解析から以下の考察をした。
・YFPのTyr145の位置にできる空隙に入った水と発色団の相互作用が蛍光特性と関わっている
・圧力とともに空隙の水が吐き出され,蛍光強度が上がると予想される(一般的には圧力とともに水との相互作用が増して消光する)
