研究紹介
GENERAL
生体分子化学研究室は、
"誰も出来ないことをやる。誰もやらないことをやる"
をモットーに、生理活性物質(薬物や毒素などの外来性の化合物)および生体低分子(脂質やホルモンなどの生物が本来持っている化合物)の3次元的な形および生体内における働きを解明することを研究目的としています。
われわれが得意とするのは、NMRなどの機器分析と化学合成ですが、これらの手法を駆使して生命現象を原子の精度でとらえるための研究を行っています。
具体的には、以下の4つの分野の研究が進行しています。
膜作用分子
1、アンフォテリシンB
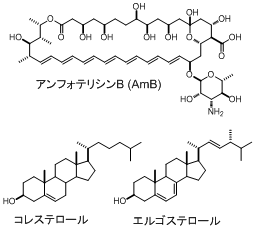 アンフォテリシンB(AmB)は放線菌Streptomyces nodosusが生産する抗真菌剤で、現在でも重篤な真菌感染症の治療に広く用いられています。
アンフォテリシンB(AmB)は放線菌Streptomyces nodosusが生産する抗真菌剤で、現在でも重篤な真菌感染症の治療に広く用いられています。
AmBは生体膜中のステロールおもびリン脂質と相互作用し、イオンチャネル複合体を形成することによって活性を発現するとされています。
その際、AmBは動物細胞膜のステロールであるコレステロールよりも、カビなどの真菌細胞膜にあるエルゴステロールと強く相互作用するため、真菌細胞膜中でイオンチャネルを形成しやすく、選択毒性が発揮されると考えられています。
しかし、AmBがコレステロールとエルゴステロールの微妙な違いを認識するメカニズムや、AmBが形成するイオンチャネル複合体の構造はいまだにあきらかになっていません。
そこで、AmBが形成するイオンチャネル複合体の構造を明らかにすることを目的として、AmBおよびステロールを19Fや13Cさらに2Hなどで標識し、固体NMR測定を行いました。これにより、AmBやステロールの脂質膜中での運動性を明らかにすることができ、AmBとエルゴステロールが膜中で直接相互作用していることが明らかになりました。さらにAmB同士やAmBとエルゴステロール間の距離測定にも成功しました。これらの情報を集めることで、最終的に複合体の構造計算を行い、チャネル複合体の構造決定を目指しています。
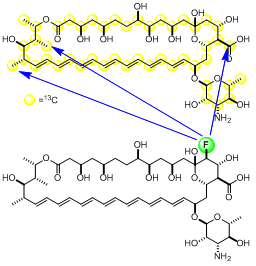
13C-AmBと19F-AmBを用いた固体NMRによる分子間距離測定
また、このようにしてAmBイオンチャネル複合体の構造および作用機構が明らかになれば、より副作用の少ない薬剤の開発につながると期待されます。
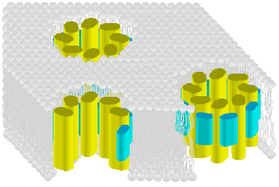
AmBチャネルの推定構造
2、脂質ラフト
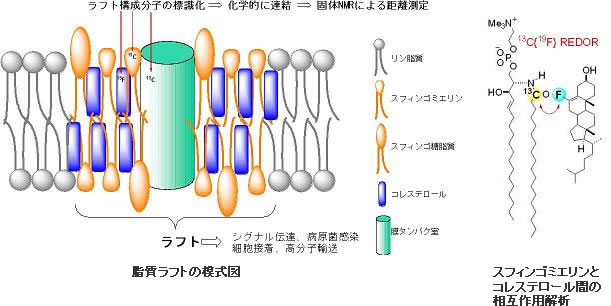
生体膜は決して均質で一様な膜ではなく、部分部分によって性質や構成成分が異なっていることが最近わかってきました。特に脂質ラフトと呼ばれる微小領域は、スフィンゴミエリンとコレステロールを主成分としており、周囲の生体膜とは異なる性質を持っています。この脂質ラフトは、シグナル伝達や病原菌の感染など生理的に重要な働きをしていますが、分子間の相互作用についてはほとんどわかっていません。そこでわれわれはこの脂質ラフトにおける分子認識機構を解明するために、スフィンゴミエリンおよびコレステロールの13C,19F,2H標識体を合成し、固体NMRによって分子間距離測定および運動性の解析を行っています。その結果、スフィンゴミエリンの脂質膜中での向きや運動性、さらに分子間相互作用についての種々の知見を得ることができました。今後はこれらの知見をもとに分子動力学計算を行い、ラフト形成のメカニズムを明らかにしたいと思っています。また、現在はラフト集積ペプチドやタンパク質とラフトとの相互作用解析に向けて、スフィンゴミエリンの蛍光標識体や光親和標識体の合成を行っています。また、酸性九炭糖シアル酸を有する糖脂質であるガングリオシドもラフト構成成分として知られ、細胞間の接着や相互作用、細菌やウイルスの感染などに関連しています。そこで、ガングリオシドの脂質ラフト内での挙動にも焦点を当ててNMRを用いた研究を進めています。
3、バイセル
バイセルはアルキル鎖の長いリン脂質と短いリン脂質からなるディスク状の脂質会合体であり、長鎖リン脂質が形成する平面部分は二重膜構造を有していることから、バイセルは最小の脂質二重膜モデルと考えられています。短鎖リン脂質に対する長鎖リン脂質の割合が多いバイセルは外部磁場に対し配向する性質を有していますが、短鎖リン脂質の割合が大きくなると、ディスク状の形状を保ったまま磁場に対して等方的に存在します。そこでわれわれは、この等方バイセルにサリノマイシンなどの膜作用性分子を導入し、通常の溶液NMR測定を行いました。その結果、これら膜作用性分子の膜中での構造と存在位置の決定に成功し、膜中での作用発現機構を明らかにすることができました。また最近ではバイセルを用いて上述の脂質ラフトを再現できることを見出し、スフィンゴミエリンの膜環境下での構造解析などにも成功しています。現在はERATOと共同してバイセルを用いた膜タンパク質や膜ペプチドの結晶化にも挑戦しています。
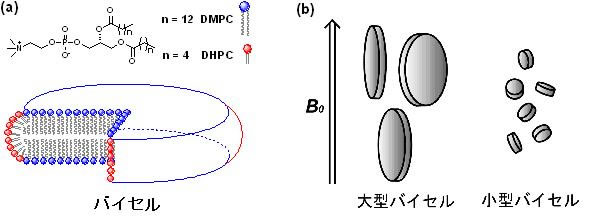
バイセルの模式図。(a)長鎖リン脂質はバイセルの平面部分で二重膜を形成。短鎖リン脂質はバイセルのヘリに存在する。(b)大型バイセルは磁場に対し配向するが、小型バイセルは等方的になる。
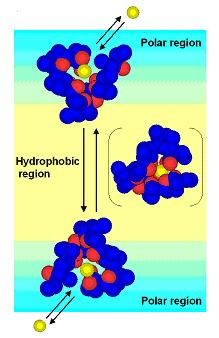
バイセルによって推定したイオノフォア抗生物質サリノマイシンのカチオン輸送機構
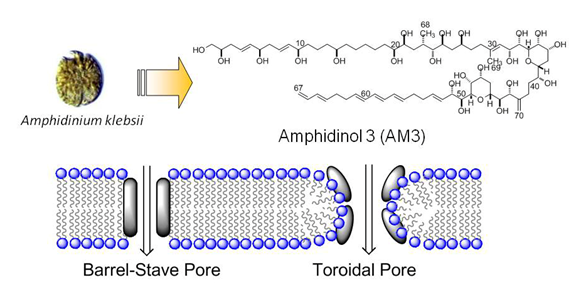
4、アンフィジノール
アンフィジノールは植物性プランクトンである渦鞭毛藻Amphidinium klebsiiが生産するユニークな構造の化合物で、特にアンフィジノール3は上記のアンフォテリシンBよりも強い溶血活性や抗カビ活性を持っています。すでにわれわれはアンフィジノール3の絶対立体配置を含む全立体構造を決定しており、さらに活性発現機構についても研究を行っています。これまでに、この化合物は生体膜に作用して複合体を形成し、AmBよりも大きな細孔(トロイダル形の細孔)をあけることで強い活性を示すことを明らかにしました。またミセルや上述のバイセルを用いて膜中でのアンフィジノール3の立体配座解析にも成功しています。さらに九州大学大石教授のグループと共同で、アンフィジノール3の部分構造を合成することで立体化学の訂正をしました。現在は高知大学津田教授と共同で、大量培養によるアンフィジノール3の供給を行い、固体NMRを用いてアンフィジノールとステロールの相互作用を解析することを計画しています。
天然物合成
1、標識化バフィロマイシン誘導体の合成
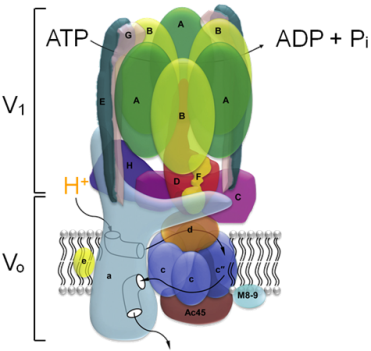
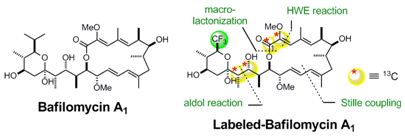
液胞型ATPアーゼ(V-ATPase)は真核生物の内膜に広く存在するプロトンポンプであり、オルガネラの内部を酸性に保つ役割を担う一方で、骨粗鬆症など様々な疾患にも深く関与しています。バフィロマイシンは代表的なV-ATPase阻害剤であり、現在、V-ATPaseが関与する様々な生理機能を解明するための分子ツールとして汎用されています。しかしながらその阻害機構に関する詳細な知見は得られておらず、新規薬剤開発の観点からもその分子レベルでの作用機構の解明が望まれています。そこで我々は、バフィロマイシンの19F, 13C標識体を合成し、固体NMRを用いた原子間距離測定によりV-ATPaseとバフィロマイシンの相互作用を解析しようと考えています。
2、スピロリドCの全合成
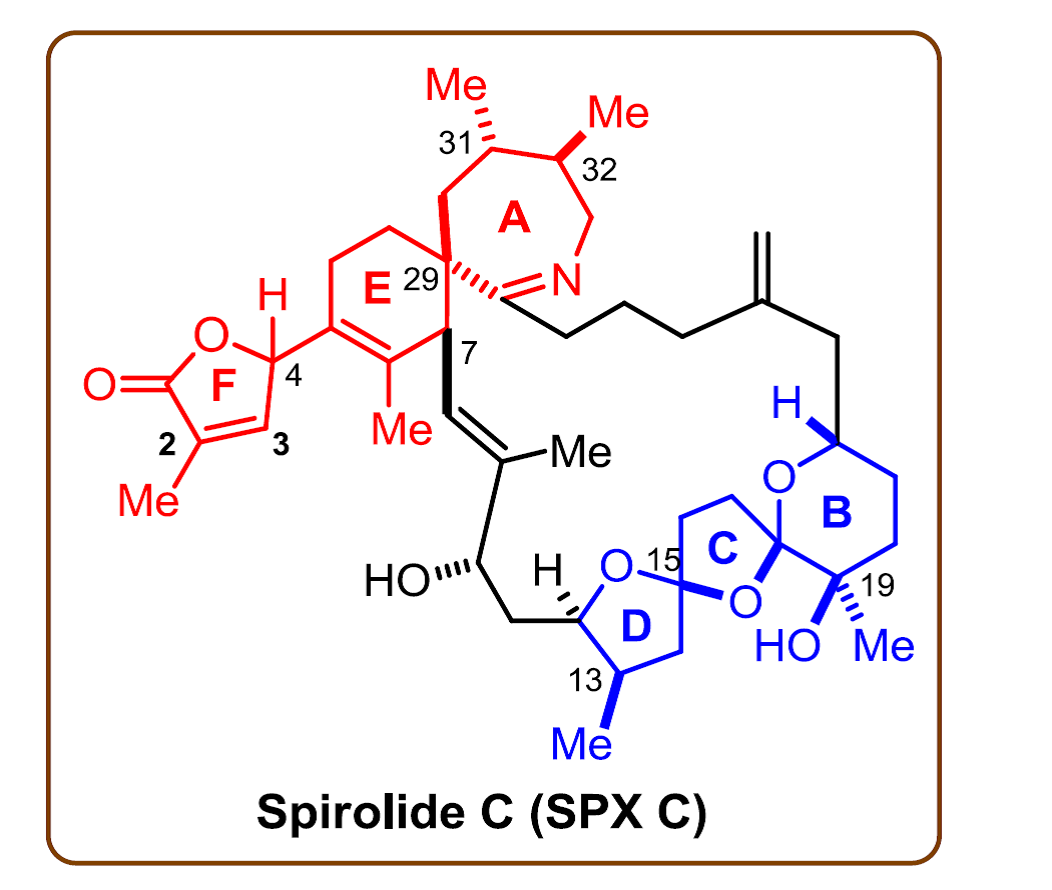 スピロイミン環を有する天然海産毒の1つであるスピロリドC (SPX C) は、アセチルコリン受容体に結合して強力なマウス急性致死毒性を引き起こすことが示唆されています。しかしながらその詳細な作用機構はおろか未だに全絶対立体配置、特に4位については相対立体配置さえも明らかにされていません。 これは、スピロリドCの構造的特徴、すなわち不安定なγ-ブテノリド(F環) が直結した7,6-スピロイミンユニット(A,E環) と、6,5,5-ビススピロケタールユニット(B,C,D環) が鎖状炭素で連結された複雑でフレキシブルな構造を有することに起因していると考えられます。そこで我々は、スピロリドCの化学合成による全立体配置の決定を目的として研究を行っています。さらには同位体標識化誘導体の調製による受容体-スピロリド複合体構造の分子レベルでの解析へと展開しようと考えています。
スピロイミン環を有する天然海産毒の1つであるスピロリドC (SPX C) は、アセチルコリン受容体に結合して強力なマウス急性致死毒性を引き起こすことが示唆されています。しかしながらその詳細な作用機構はおろか未だに全絶対立体配置、特に4位については相対立体配置さえも明らかにされていません。 これは、スピロリドCの構造的特徴、すなわち不安定なγ-ブテノリド(F環) が直結した7,6-スピロイミンユニット(A,E環) と、6,5,5-ビススピロケタールユニット(B,C,D環) が鎖状炭素で連結された複雑でフレキシブルな構造を有することに起因していると考えられます。そこで我々は、スピロリドCの化学合成による全立体配置の決定を目的として研究を行っています。さらには同位体標識化誘導体の調製による受容体-スピロリド複合体構造の分子レベルでの解析へと展開しようと考えています。
3、KRN7000 (α-ガラクトシルセラミド) の合成
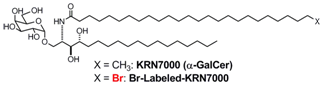
 KRN7000は?-ガラクトシルセラミドと呼ばれる糖脂質であり、海綿より単離された天然物の構造改変により得られた強力な抗腫瘍活性物質です。その作用機構として、免疫細胞表面に発現する抗原提示タンパク質CD1dに結合し、ナチュラルキラーT細胞表面のTCRと三者複合体を形成して種々のサイトカイン産生を誘導することが知られています。脂質リガンドであるKRN7000とCD1dとの共結晶X線構造解析によりその結合様式が示されている一方、これを基にした新規薬剤の合成研究は、いまだ優れた薬剤開発にいたっていません。我々は、この理由として共結晶構造の中でもリガンド、特にその脂質鎖の電子密度が低く精密なリガンドデザインが困難であるためと考えています。そこで、低い電子密度でもより正確に原子の位置を決定できる新規手法の開発を目指して、標識化KRN7000の合成をおこなっています。
KRN7000は?-ガラクトシルセラミドと呼ばれる糖脂質であり、海綿より単離された天然物の構造改変により得られた強力な抗腫瘍活性物質です。その作用機構として、免疫細胞表面に発現する抗原提示タンパク質CD1dに結合し、ナチュラルキラーT細胞表面のTCRと三者複合体を形成して種々のサイトカイン産生を誘導することが知られています。脂質リガンドであるKRN7000とCD1dとの共結晶X線構造解析によりその結合様式が示されている一方、これを基にした新規薬剤の合成研究は、いまだ優れた薬剤開発にいたっていません。我々は、この理由として共結晶構造の中でもリガンド、特にその脂質鎖の電子密度が低く精密なリガンドデザインが困難であるためと考えています。そこで、低い電子密度でもより正確に原子の位置を決定できる新規手法の開発を目指して、標識化KRN7000の合成をおこなっています。
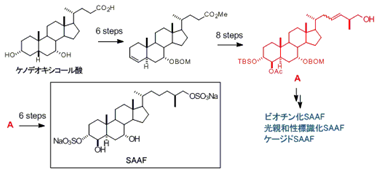
4、ホヤ精子活性化誘引物質(SAAF)の合成
受精の際、精子が卵に遭遇する確率を高める仕組みのひとつとして、卵由来の物質が精子の運動能を上げるといった精子活性化現象や、精子を卵の方へ引き寄せるといった精子走化性現象が知られています。我々はカタユウレイボヤの卵子からこの両活性を有する物質の単離に成功し(僅か4 μg)、精子活性化誘引物質(SAAF)と命名しました。また、NMRおよびMS分析により推定した構造を化学合成により証明するとともに、その合成化学的供給を実現しました。現在、確立した合成法を利用して種々の標識化誘導体の合成を検討しており、SAAFの活性発現機構についても研究を進めています。