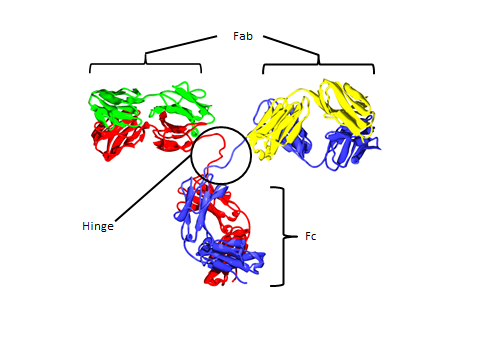
Fig. 1. Molecular structure of IgG.

Fig. 1. Molecular structure of IgG.
蛋白質は生体内で水やイオン等とともに多成分系を形成し,酵素反応等の機能を発現しています.特に水は蛋白質が運動する上で非常に大きな役割を果たしています.しかし蛋白質のダイナミクスは明らかにされていないところが多いので,研究が盛んに行われています.我々はその一つの例として免疫グロブリンG(IgG)と呼ばれる蛋白質の水溶液中でのダイナミクスに注目しました.IgG(Fig.1)は3つの領域(2つのFabと1つのFc)から成る抗体で,その3つの領域はヒンジ領域と呼ばれるペプチド鎖により相互につながっており,生体内においてこのヒンジ領域を動かすことで抗原と結合します(ヒンジベンディング).蛋白質のダイナミクスは熱容量測定ではガラス転移として観測できるので,このヒンジベンディング運動やIgGに水和した水分子との相関が熱容量測定を行うことで解明されると考えました.本研究では様々な濃度におけるIgG水溶液およびその乾燥試料の熱容量を測定し,そのダイナミクスや水との相関を調べました.
IgGは牛由来のものを購入し,透析及び凍結乾燥によりイオンなどの不純物を取り除いたものを用いました.IgG水溶液の濃度は溶質%で5,10,20,50,80,90,95%であり,乾燥試料にミリQ水を加えることで濃度を調整しました.熱容量測定は研究室既設の断熱型ミクロカロリメーターを使い,低濃度(5 – 50%)においては急冷(−2~−3 K min-1)した試料と,230 Kにおいてアニールした試料について行い,高濃度(80 – 95%)は急冷試料のみについて行いました.
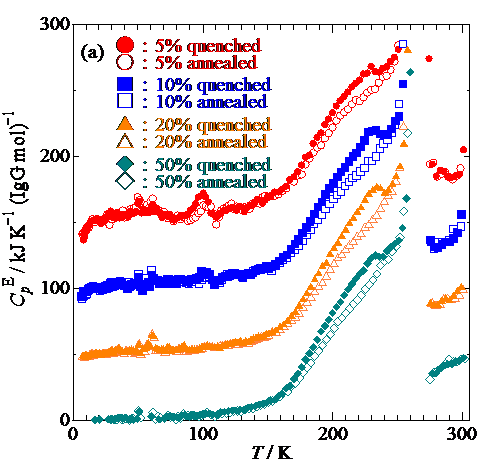
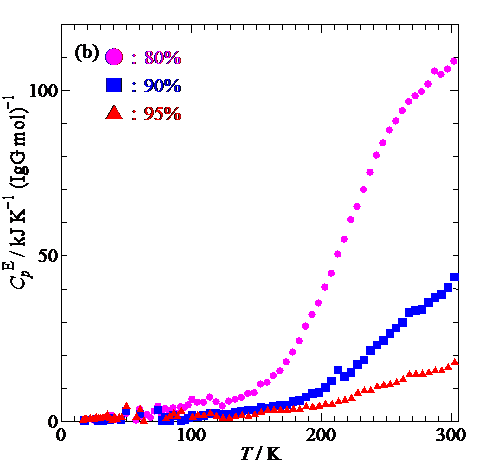
Fig. 2. Excess heat capacity of hydrated IgG at concentration of 5 – 50%(a) and 80 – 95%(b) 5 – 20% are shifted upwards for sake of clarity.
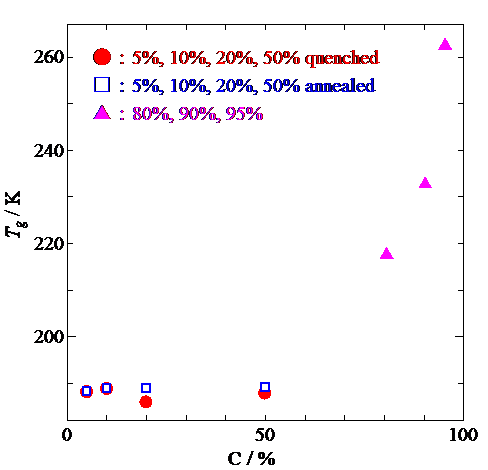
Fig. 3. Concentration dependence of glass transition temperature.
過剰熱容量(Fig.2)からわかるように,低濃度試料における急冷,アニール測定でIgGに水和していない水(自由水)による融解が273 K付近に観測されています.一方で高濃度試料ではそのような熱異常が見られないことから,自由水が存在しないことがわかります.さらに,低濃度の急冷試料とアニール試料の過剰熱容量において200 K前後の温度域にブロードなガラス転移が観測されました.この温度域において,低濃度の急冷試料の測定中に230 K近傍で発熱が見られました.発熱は過冷却水の結晶化によるものですが,水和水はIgGと結合しているため凍らず,自由水は結晶化しているので,観測されたガラス転移の過剰熱容量は,他の不凍水が関係していることが示唆されました.一方で高濃度試料の測定においてもガラス転移が観測されましたが,低濃度試料とは異なり,濃度増加とともによりブロードかつ200 Kよりも高い温度でガラス転移が生じました.ガラス転移点の濃度依存性(Fig.3)から,水和水がIgGとの間で協同的な運動をすることでIgGの可塑性を高めていることがわかりました.
今後はIgGのヒンジ領域を切断して同様に熱容量を測定し,今回の結果と比べることでヒンジベンディングの運動の抽出ができると期待しています.
Copyright © Research Center for Structural Thermodynamics, Graduate School of Science, Osaka University. All rights reserved.