金属錯体を用いた蛋白質N端アミノ酸配列決定法
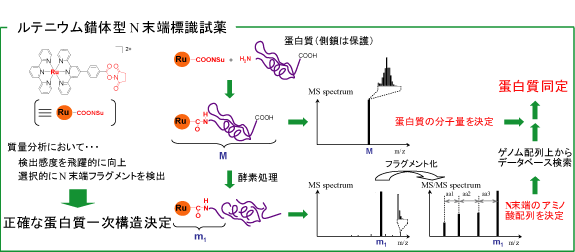
ヒトゲノム計画が終わり,ポストゲノムとしてプロテオミクスが注目されています。ゲノムは遺伝子の情報ですが,実際に機能するのは蛋白質です。現在,生物の個体で発現している蛋白質を網羅的に調べ機能を理解しようとするのがプロテオミクス(プロテオーム解析)です。具体的には個体から得た蛋白質を二次元電気泳動などで分離し,蛋白質のアミノ酸配列をゲノムデータベースを用いて決定し,蛋白質を同定します。未知蛋白質の場合は大量発現により蛋白質を得,構造解析,活性などにより詳細に決定する必要があります。アミノ酸配列の決定には微量分析が可能な質量分析がもちいられています。プロテオミクスは既に自動化されてきており発現量の多い蛋白質についてはアミノ酸配列決定,同定が迅速に行われるようになってきました。しかし,発現量の少ない極微量の蛋白質や,大量発現が必要な未知蛋白質はより微量かつ正確にN端のアミノ酸配列を決定する手法が望まれています。
私たちは錯体化学で得られた知見から,極めて安定なビス(ターピリジン)ルテニウム錯体が質量分析においてイオン化されやすく,特徴的な同位体パターンにより極めて容易にノイズとの区別がされ,高感度で検出できることを見出しました。これをペプチドのN端に結合させ,酵素処理,MS/MS解析によりN端アミノ酸配列を決定できることを明らかにしました。

その他のテーマ
配位子原子への水素結合による金属錯体の反応制御
Photoactive Yellow Protein の発色団のモデル化による光サイクルの解明とそれをモデルにした機能性分子の開発
非天然型アミノ酸からなるポリペプチドによる二次構造の制御・構築