ある標的分子に特異的に、かつ強く結合する生体高分子「抗体」を利用した新規超分子の合成および高感度センシングシステムを開発しています。さらに抗体と人工の機能性低分子を融合した新しい機能性触媒やエネルギー変換材料を創製します。
抗体デンドリマー:抗体を1ユニットとして合成された樹状超分子(2003)
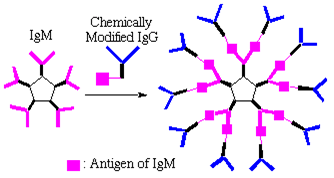
抗体IgM抗体を核に、化学修飾したIgG抗体を分岐として抗原抗体反応によって抗体を連結した新規樹状超分子を合成した。カチオン性ポルフィリンを免疫して得られた抗体IgMと、カチオン性ポルフィリンを修飾して得られた化学修飾抗体IgGを混ぜ合わせるとIgMがIgG上の抗原に結合し、「抗体デンドリマー」が得られる。本抗体超分子は分子量が200万を超える巨大分子集合体であり、非共有結合を介したデンドリマーである。抗体デンドリマーの構造を原子間力顕微鏡(AFM)により観察した結果、集合体の直径はIgMの約2倍で、外側に分岐が観測された。化学修飾抗体のみあるいはIgMのみではこのような集合体は見られなかったことから、混合溶液から得られたAFMイメージはIgMの周りにIgGが特異的に集積してできた超分子構造であると考えられる。この抗体デンドリマーの基質特異性は極めて高い。IgM、IgGおよび抗体デンドリマーの基質との親和性を酵素標識抗体測定法(ELISA)により調べた結果、抗体IgGに修飾したカチオン性ポルフィリンはIgMの結合部位に結合し、遊離の結合部位は 存在しないと考えられる。
Harada, A.; Yamaguchi, H.; Tsubouchi, K.; Horita, E. Chem. Lett. 2003, 32, 18–19.
DNA カテナンの直接観察:環状DNAの絡み合い分子をAFMで観察した初めての例(2000)
近年、2個以上の環状化合物が互いに「知恵の輪」のように連結している化合物「カテナン」に多大の関心が寄せられている。これはカテナンが粘弾性に富む材料や新規刺激応答材料としての機能発現が期待できるからである。カテナンの構成ユニットに生体高分子を用い、それらを人工的に組織化・集積化することができれば、生体高分子の本来の機能に新たな機能を付与することが可能になると期待される。本研究では、高度な情報を担うDNAを超分子構造形成のための材料として注目した。本トピックスでは環状DNAを非共有結合で連結したDNAカテナンの構造観察について述べる。
市販のプラスミドDNA(環状DNA、pBR322)は溶液中、開環状(弛緩した輪)と閉環状(1分子内でDNA2本鎖同士が巻き付いた構造)DNAに起因する2種類の構造が存在する。電気泳動で分離された2つのバンドからそれぞれDNAを 抽出し、原子間力顕微鏡(AFM)測定を行った。AFM測定はシリコン単結晶の探針を用いて、タッピングモードで大気中室温において行った。その結果、視野内すべてのDNA分子イメージが開環状あるいは閉環状構造になっていることがわかった。これは電気泳動バンドから抽出された溶液中のDNA構造がAFM測定時においても保持されていることを示している。
プラスミドDNAにDNase Iを添加することにより閉環状DNAを開環状構造体に変化させた。ここにトポイソメラーゼIを添加した結果、新たな電気泳動バンドが現れた。このバンドから抽出されたDNAのAFMイメージでは鎖長がDNAモノマーの鎖長(約1.5 μm)の2倍で、かつDNA鎖が絡み合ってカテナン構造を形成していることがわかった。
Yamaguchi, H.; Kubota, K.; Harada, A. Chem. Lett. 2000, 29, 384–385.
カチオン性 / アニオン性ポルフィリン間での星型超分子結晶形成 (2001)

アニオン性のポルフィリン(Tetrasodium [meso-tetrakis(4-sulfonatophenyl)por-phinato]zinc, Zn-TSPP) とカチオン性のポルフィリン (meso-tetrakis(4-(trimethylammo-nio)phenyl)porphine tetratosylate, TTMAPP) を DMSO 中で混合すると星型の超分子構造が形成されることを発見した。TTMAPP の代わりにmeso-tetrakis(N-methylpyridinium-4-yl)porphine p-toluenesul-fonate (TMPyP) を用いるとこのような構造が得られなかった。種々の実験結果から星型の超分子構造形成にはポルフィリン上の電荷の位置や置換基の構造、溶媒分子などが影響していることがわかった。イオン性ポルフィリンの組み合わせを変化させることによってメソスケールの超分子構造を制御することが可能になった。
Yamaguchi, H.; Harada, A. Chem. Lett. 2001, 30, 778–779.
ポルフィリンに対する抗体の機能と構造との相関 (2000)
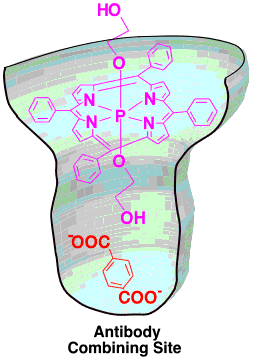
ポルフィリンの軸上にテレフタル酸を結合した化合物に対するモノクローナル抗体を5種作製した。そのうちの1種、74D7A は免疫に用いたポルフィリンのみならずテレフタル酸に対しても選択的に結合した。さらにこの抗体は電子ドナーであるポルフィリンと電子アクセプターであるテレフタル酸を同時に結合することにより、光誘起電子移動反応を加速した。
Yamaguchi, H.; Kamachi, M.; Harada, A. Angew. Chem. Int. Ed.,2000, 39, 3829-3831.
人工ポルフィリンータンパク質錯体で最も効率の良い水素発生システムの構築 (2006)
水溶性の合成ポルフィリン (テトラカルボキシフェニルポルフィリン, TCPP) に結合するモノクローナル抗体を数種類得た。そのうちの1種、抗体 2B6 は TCPP のみならずその亜鉛錯体 (Zn-TCPP) とも錯体を形成することがわかった。抗体-Zn-TCPP 錯体に電子アクセプターとしてメチルビオロゲン (MV2+) を添加すると、Zn-TCPP から MV2+ への光誘起電子移動が促進され、安定な電子移動生成物 (ラジカルカチオン種) が得られることを見出した。このポルフィリン-抗体錯体を光増感剤として用い、白金コロイド存在下、新規水素発生システムを構築することができた。
Onji, T.; Ohara, H.; Yamaguchi, H.; Ikeda, N.; Harada, A. Chem. Lett. 2006, 35, 1126–1127. Yamaguchi, H.; Onji, T.; Ohara, H.; Ikeda, N.; Harada, A. Bull. Chem. Soc. Jpn. 2009, 82, 1341–1346. (BCSJ Award Article)
バイオセンサー基板上での超分子形成を利用した微量毒物検出 (2002)
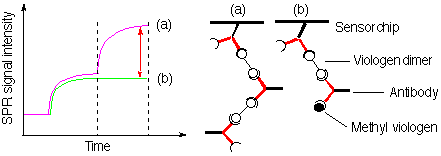
ここではメチルビオロゲンの検出法について述べる。メチルビオロゲンは光化学における電子受容体としてよく用いられている。また除草剤としても用いられていた反面、パーキンソン病をひき起こす物質の一つとしても知られる有害物質である。メチルビオロゲンは電荷を有する低分子化合物であるため、SPR型バイオセンサーで特異的に微量検出することは分子量の点から困難である。また電荷を持つ分子は濃度が濃くなるとセンサー表面に非特異的吸着が起こるため、測定誤差が大きい。このメチルビオロゲンの検出にモノクローナル抗体を用いた。しかし抗メチルビオロゲン抗体を固定したセンサーチップ基板にメチルビオロゲンを添加したが、微量のメチルビオロゲンを検出することは困難であった。これは先に述べたようにメチルビオロゲンそのものの分子量が小さいためにバイオセンサーの応答シグナル強度が小さいことに起因する。メチルビオロゲンを特異的にかつ高感度で検出するためには抗体がメチルビオロゲンに結合したことを大きなシグナルとして取り出す必要がある。この問題を克服するシグナル増幅法の一つが抗体と2価性抗原との超分子形成である。2価性抗原とその抗原に相補的な抗体を等量ずつ混合すると、線状もしくは環状の会合体を形成する。 抗体を固定したセンサーチップに2価性抗原と抗体を順次添加するとSPRの応答シグナル強度は抗原-抗体間の会合体(超分子)の成長とともに増大する。ここで2価性抗原であるビ オロゲンダイマーの代わりにメチルビオロゲンを添加すると、センサーチップ上に固定された超分子の末端にある抗体の結合部位にメチルビオロゲンが結合し、ビオロゲンダイマ-と抗体の超分子形成ができなくなる。つまりビオロゲンモノマー(メチルビオロゲン)は超分子形成を阻害することになる。この手法においてメチルビオロゲン添加は次のステップの抗体―ビオロゲンダイマー間の超分子成長反応に影響を与える。メチルビオロゲンの分子量257の応答シグナル強 度は分子量15万の抗体の結合阻害挙動に置き換わることになる。
本システムの感度は低分子を抗体固定基板に添加する単純系の140倍になることがわかった。
Yamaguchi, H.; Harada, A. Biomacromolecules, 2002, 3, 1163–1169.
爆発物質を特異的に検出できるモノクローナル抗体の作製 (2013)
Matsumoto, T.; Yamaguchi, H.; Kamijo, K.; Akiyoshi, M.; Matsunaga, T.; Harada, A. Bull. Chem. Soc. Jpn. 2013, 86, 198–202.
(BCSJ Award Article) Cover Picture
爆発物の一つでる過酸化アセトン (TATP) に結合するモノクローナル抗体を作製した。TATP と化学構造が類似する安定なスピロ環化合物を抗原決定基に用いることにより抗TATP抗体を作製することに成功した。表面プラズモン共鳴法を検出原理とするバイオセンサーにおいて本抗体を利用すると、μM レベルのTATPを検出することができた。
抗ビナフチル抗体を用いたキラルセンシングシステムの構築 (2017)
Odaka, T.; Adachi, T.; Harada, A.; Yamaguchi, H. Chem. Lett. 2017, 46, 1173-1175.
Editor's Choice
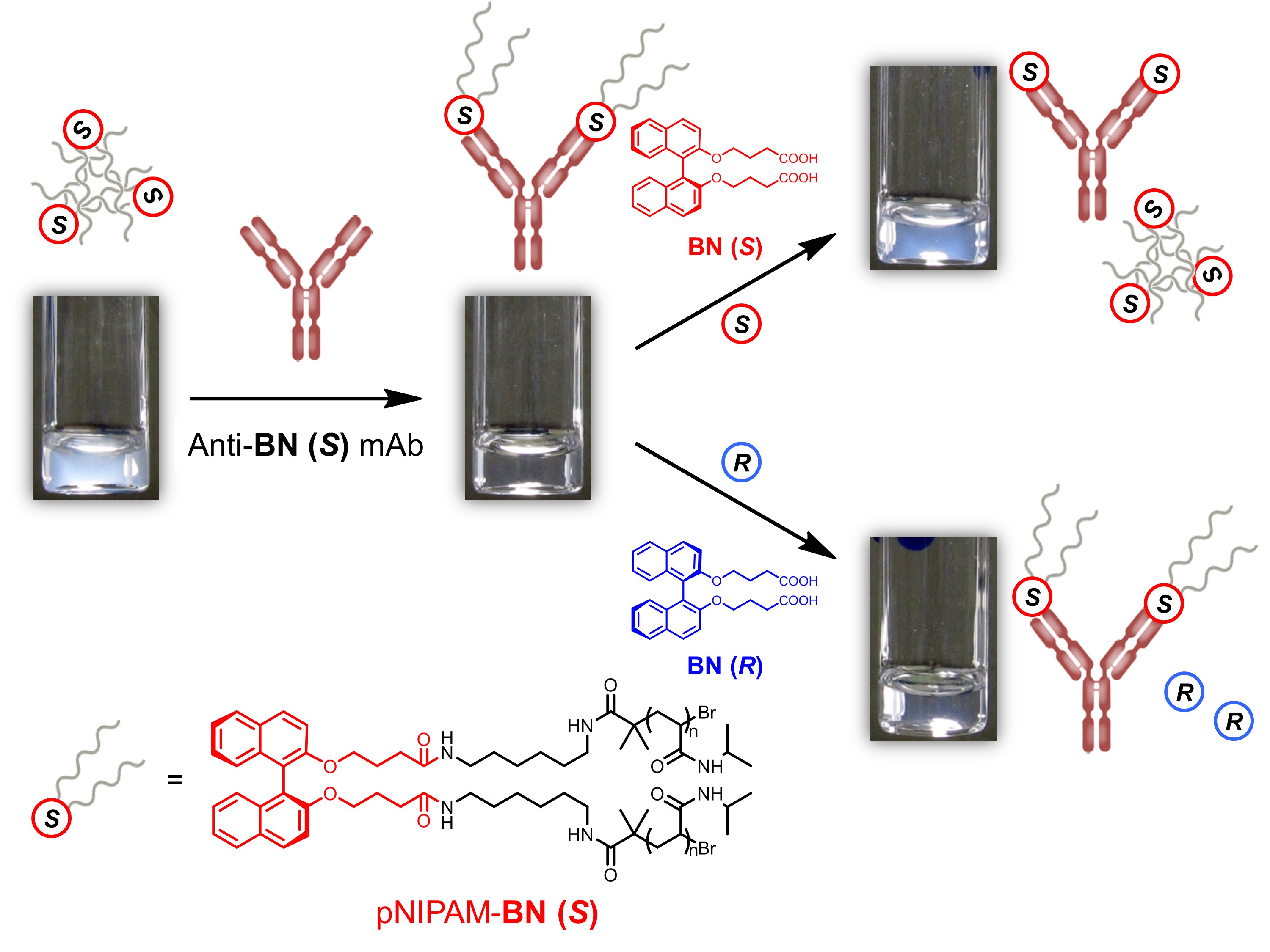
抗ビナフチル抗体を用いて簡便なキラルセンシングシステムを構築した。一方の光学異性体BN (S) をポリN-イソプロピルアクリルアミドの中央部にリンカーを介して導入したpNIPAM-BN (S) と抗BN (S) 抗体を混合すると、その溶液の下限臨界溶液温度 (LCST) がpNIPAM-BN (S) のみの系よりも高くなる挙動を見出した。一方、BN (R) を導入したポリマーpNIPAM-BN (R) に抗BN (S) 抗体を添加してもそのLCST は変わらなかった。pNIPAM中のBNにモノクローナル抗体が結合することによりpNIPAM の凝集挙動が変化することがわかった。抗BN (S) 抗体存在下、pNIPAM-BN (S) の水溶液にBN (R) そのものを添加しても水溶液の状態に変化は見られないが、BN (S) を混合すると再び溶液が白濁した。抗体に結合する相手がpNIPAM 中のBN (S) から遊離のBN (S) に組み変わることで再び元のpNIPAM-BN (S) の凝集が起こったと考えられる。熱応答性高分子を利用して抗体のキラル認識を可視化することができた。
ビナフチル化合物の軸不斉を認識するモノクローナル抗体の作製 (2019)
Adachi, T.; Harada, A.; Yamaguchi, H. Bull. Chem. Soc. Jpn. 2019, 92, 1462-1466.
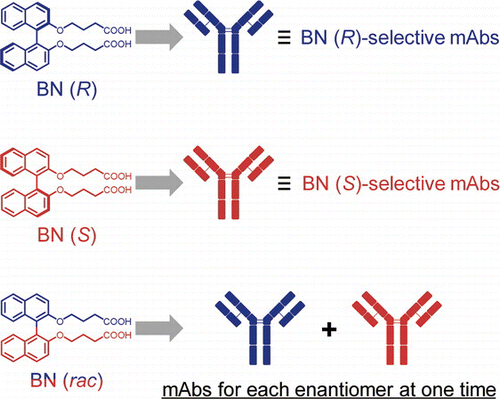
キラルなビナフチル化合物 (BN) のラセミ体 (BN (rac)) を抗原決定基として用いてマウスに免疫を行い、モノクローナル抗体 (mAb) を作製した。mAb 34H12は BN (S) よりも BN (R) を1700倍強く結合した。mAb 9H3 は 14000倍の結合力差で BN (S) をキラル選択的に結合した。BN (rac) を用いて免疫を行うことにより BN (R) 特異的な抗体と BN (S) 特異的な抗体を一度に得ることに成功した。得られた抗体は 1,1’-ビ-2-ナフトール (BINOL) や1,1’-binaphthyl-2,2’-diyl hydrogen phosphate (BNPA) の軸不斉も認識した。
抗体ーポルフィリン錯体による基質選択的な過酸化反応 (1997)
アニオン性ポルフィリン (meso-tetrakis(4-carboxyphenyl)porphyrin, TCPP)に対して作製された抗体 03-11-3はTCPPのMn錯体 (MnIII-TCPP) や Fe 錯体 (FeIII-TCPP) に対しても結合した。天然の過酸化酵素の1種である西洋わさびペルオキシダーゼ (HRP) は様々な基質に対して触媒活性を示すのとは対照的に、抗体 03-1- FeIII–TCPP 錯体は基質としてピロガロールを用いた場合にのみ過酸化反応を触媒した4。
(1) Harada, A.; Okamoto, K.; Kamachi, M.; Honda, T.; Miwatani, T. Chem. Lett. 1990, 19, 917–918.
(2) Harada, A.; Okamoto, K.; Kamachi, M. Chem. Lett. 1991, 20, 953–956.
(3) Harada, A.; Shiotsuki, K.; Fukushima, H.; Yamaguchi, H.; Kamachi, M. Inorg. Chem. 1995, 34, 1070–1076.
(4) Harada, A.; Fukushima, H.; Shiotsuki, K.; Yamaguchi, H.; Oka, F.; Kamachi, M. Inorg. Chem. 1997, 36, 6099–6102.
時として天然酵素に勝る触媒活性をもつ抗体ーポルフィリン錯体 (2004)
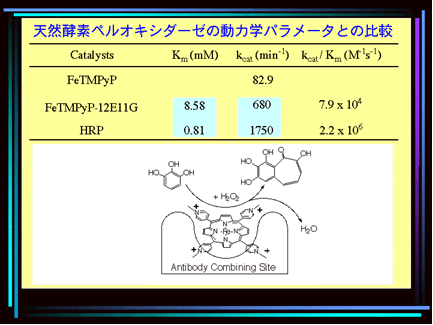
カチオン性ポルフィリン (5-(4-carboxyphenyl)-10,15,20-tris(4-methylpyri-dyl)porphine iodide, 3MPy1C) に対して作製された抗体 12E11G はtetramethylpyridylporphyrin ironcomplex (FeIII–TMPyP) に対しても結合した。抗体12E11G- FeIII–TMPyP 錯体はピロガロール、カテコール、グアイアコールの酸化反応を触媒した。このカチオン性ポルフィリン-抗体の錯体はアニオン性ポルフィリン-抗体の系よりも高い触媒活性を示しただけでなく、天然の過酸化酵素の1種である HRP が触媒活性を低下させるような高濃度の過酸化水素存在下においても触媒活性を維持した。
Yamaguchi, H.; Tsubouchi, K.; Kawaguchi, K.; Horita, E.; Harada, A. Chem. Eur. J. 2004, 10, 6179–6186.生体系に存在しない遷移金属錯体に対して作製された世界で初めての抗体 (2006)
抗体の厳密な分子認識能を利用した立体選択的水素化触媒 (2006)
生体内には存在しない遷移金属錯体 (アキラルなロジウム錯体) に対して特異的に結合するモノクローナル抗体を作製し、得られた抗体とロジウム錯体との複合体の機能を検討した。抗体とロジウム錯体との複合体を含む水溶液にアラニン前駆体である2-アセトアミドアクリル酸を基質として添加した。この溶液に水素をバブリングし、37 ℃で12時間反応させた後、キラルHPLCおよびGCにおいて反応生成物を分析した。抗体非存在下ではN-アセチルアラニンのラセミ体が得られるのに対して、抗体存在下ではL体が生成していることがわかった。抗体の結合によりロジウム錯体の触媒能は向上した。本抗体はロジウム錯体と水溶液中で安定な錯体を形成し、基質特異性を有する極めて厳密な不斉水素化触媒となることが明らかになった。
Yamaguchi, H.; Hirano, T.; Kiminami, H.; Taura, D.; Harada, A. Org. Biomol. Chem. 2006, 4, 3571–3573.
光照射によって ON / OFF 制御可能なヒドロゲル集積システム (2012)
Yamaguchi, H.; Kobayashi, Y.; Kobayashi, R.; Takashima, Y.; Hashidzume, A.; Harada, A. Nat. Commun. 2012, 3, 603.
光応答性を有するアゾベンゼン (Azo) とシクロデキストリン (CD) をそれぞれ導入したヒドロゲルを用いて、光照射でゲルを接着・解離させることができるシステムを開発した。α-CD ゲル、β-CD ゲル、trans-Azo ゲルを水中にて同時に震とうすると、α-CD ゲルが選択的に trans-Azo ゲルと接着した。α-CD ゲルと trans-Azo ゲルの集合体に 365 nm の光を照射後。振とうするとAzo ゲルに接着していた α-CD ゲルが解離し、代わりに β-CD ゲルが Azo ゲルと選択的に接着することがわかった。光照射でゲルの集積を ON / OFF 制御するとともに、接着する相手をスイッチできるシステムを開発することに成功した。
鉄ポルフィリンとヒスチジンの配位結合を利用したヒドロゲル集積システム (2013)
Kobayashi, Y.; Takashima, Y.; Hashidzume, A.; Yamaguchi, H.; Harada, A. Sci. Rep. 2013, 3, 1243.
ヘモグロビン、ペルオキシダーゼやシトクロム等では、タンパク質が補因子として複合体を作ることでそれぞれの酸素運搬、酸化還元酵素、電子伝達等の機能を発現している。金属ポルフィリンの金属部位にタンパク質などの特定のアミノ酸が配位し、その配位結合の強さを調整することでこれらの機能を発現する。本研究では、金属ポルフィリンとアミノ酸をそれぞれ導入したゲルを合成し、これらのヒドロゲルを配位結合による集積することが可能なシステムを構築した。
鉄ポルフィリン (Fe-Por) とL-ヒスチジン (L-His) をそれぞれポリアクリルアミドゲルに導入した。Fe-Por ゲルと L-His ゲルを緩衝液中で振動すると、接触と同時に2種類のゲルが接着・集積した。Fe-Por ゲル同士あるいはL-His ゲル同士ではこのようなゲルの接着は見られなかった。Fe-Por ゲルと L-His ゲルの集積体に L-His の水溶液を添加すると、個々のゲルに解離した。これらのゲルを洗浄すると再びゲルが自己集積した。このゲル着脱はpH 応答性を示し、pH 9.0 では接着、pH 2.0 では解離する。フリーベースポルフィリン (2H-Por) のゲルは L-His ゲルと接着しないが、2H-Por に鉄を導入する反応を行うと L-His ゲルと接着することがわかった。Fe-Por と L-His の金属-配位子間相互作用によってゲルが接着していることがわかった。鉄の代わりに亜鉛が配位した Zn-Por のゲルも合成し、Fe-Por、Zn-Por、L-His の3種ゲルを同時に振動すると、L-His ゲルは強く配位する Fe-Por ゲルとのみ特異的に集積体を形成した。
アポタンパク質導入ゲルと補因子固定ゲルとの接着現象を利用した触媒活性制御 (2015)
Kobayashi, Y.; Takashima, Y.; Hashidzume, A.; Yamaguchi, H.; Harada, A. Sci. Rep. 2015, 5, 16254.
ヘム酵素の一つである西洋わさびペルオキシダーゼ (HRP) から補因子 (FePor) を抜き出したアポタンパク質 (apoHRP) と FePor をそれぞれポリアクリルアミドゲル (pAAm ゲル) に導入した。apoHRP ゲルとFePor ゲルを4 ℃で接触させたところ、ゲルが接着した。種々の比較実験より、これらのゲルの接着が apoHRP と FePor の錯体形成に基づいていることが示唆された。apoHRP ゲルと FePor ゲル存在下、HRP の基質となる 2,2'-azino-bis(3-ethyl benzothiazoline-6-sulphonic acid) (ABTS) の酸化反応を観察した。apoHRP ゲルと FePor ゲルを接着させると ABTS の酸化反応速度が加速された。これに対し、apoHRP ゲルと PAAm ゲル、pAAm ゲルと FePor ゲルの組み合わせではこのような酸化反応は起こらなかった。ABTS の酸化反応速度は apoHRP 及び FePor ゲルの導入量および2種のゲルの接着面積に比例することがわかった。apoHRP ゲルと FePor ゲルを接着させると ABTS の酸化反応が加速され、離すと反応が進行しなくなった。2種類のゲルの接着-解離によって触媒反応を制御できることがわかった。
ドナー-アクセプター (DA) 相互作用によって架橋された超分子材料の力学特性 (2019)
Itano, M.; Kobayashi, Y.; Takashima, Y.; Harada, A.; Yamaguchi, H. Chem. Commun. 2019, 55, 3809-3812.
ピレン (py) とトリニトロベンゼン (TNB) を同一の主鎖に導入した高分子を合成した。この高分子をDMSOに溶解後、乾燥させることによって DA エラストマーを得た。DA エラストマーの破壊エネルギーは共有結合で架橋されたエラストマーよりも3倍高かった。走査速度を変化させて引張試験を行ったところ、DA エラストマーは 1 mm / s の引張速度においては 0.1 mm / s のときよりも13倍高い破壊エネルギーを示した。比較対象である共有結合で架橋されたエラストマーの破壊エネルギーは引張速度に依存しなかった。これらの結果は低い引張速度のときはDA 錯体が徐々に解離するのに対し、速い引張速度の際は一度に多数のDA錯体が解離させられることに起因していると考えられる。DA相互作用という弱い非共有結合を用いることにより引張速度によって材料強度を変化させる超分子材料を創製することに成功した。
自己修復性と形状記憶性を有する水素結合と金属-リガンド相互作用によって架橋された超分子材料 (2019)
Kobayashi, Y.; Hirase, T.; Takashima, Y.; Harada, A.; Yamaguchi H. Polym. Chem. 2019, 10, 4519-4523.
Back Cover

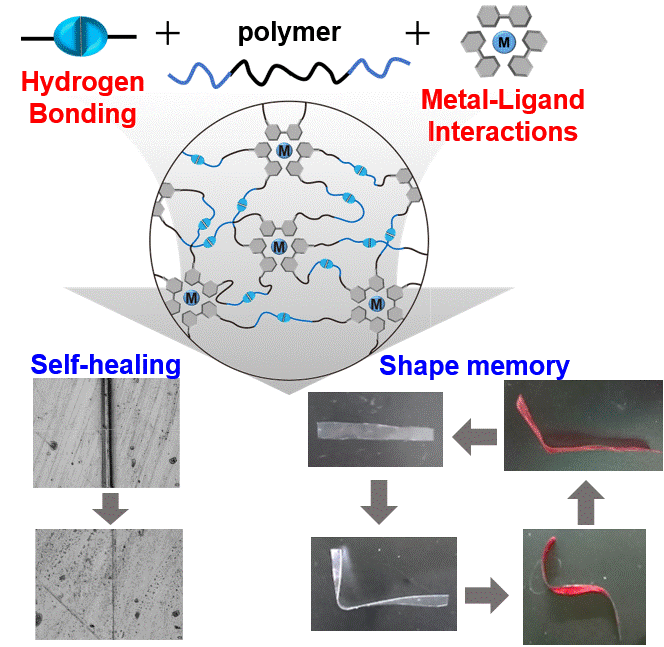
DNAやタンパク質などの生体高分子は複数の非共有結合を介して複雑でかつ明確な構造を構築し高度な機能を発現する。本研究では複数の相互作用を組み合わせることにより高度な機能発現ができると考え、水素結合と金属-リガンド相互作用の2種の非共有結合部位をもつ新たなポリマーを合成した。非共有結合部位を持たないフィルムは非常に脆かったのに対し、水素結合を持つフィルムは柔軟性を示し、更に水素結合と金属-リガンド相互作用を導入したフィルムは、水素結合のみを持つフィルムよりも4倍も高い破壊エネルギーを有していた。加えて、この2種類の非共有結合を有するフィルムは自己修復性と形状記憶特性を示した。
水溶性ポルフィリンとポリビニルピロリドンとの複合体形成による光誘起電子移動の制御
Cao, Y.; Takasaki, T.; Yamashita, S.; Mizutani, Y.; Harada, A.; Yamaguchi, H. Polymers, 2022, 14, 1191.
自然の光合成系では、タンパク質が電子供与体から受容体への電子移動を制御していることにヒントを得て、本研究では、この制御効果を実現するために人工高分子の利用を試みました。ポリビニルピロリドン(PVP)は、色素である5,10,15,20-tetrakis-(4-sulfonatophenyl) porphyrin (TPPS) およびその亜鉛錯体(ZnTPPS)と異なる相互作用(それぞれ水素結合、配位結合)で定量的に錯体を形成することがわかりました。これらの錯体形成は基底状態のTPPSまたはZnTPPSと電子受容体(メチルビオローゲン、MV2+)の相互作用を妨げ、TPPSまたはZnTPPSからMV2+への光誘起電子移動を制御し、より多くの電子移動生成物メチルビオローゲンカチオンラジカル(MV+-)を与えることがわかりました。ポリエチレングリコール(PEG) などの他のポリマーでは同様の結果が得られなかったことから,PVP が光誘起電子移動の制御に重要な役割を担っていることが示唆された。
光誘起電子移動における高分子マトリックス効果
Cao, Y.; Sotome, H.; Kobayashi, Y.; Ito, S.; Yamaguchi, H. J. Photochem. Photobiol. A, 2024, accepted.
自然の高効率な光合成システムから着想を得て、ポリ(N-メチル-4-ビニルピリジニウム)(P4VPMe)ポリマーマトリックス内における人工光誘起電子移動(PET)システムを開発しました。このシステムは、電子供与体として5,10,15,20-テトラキス(4-スルホナトフェニル)ポルフィリン(TPPS)及びその亜鉛錯体(ZnTPPS)、そして電子受容体としてメチルビオロゲン(MV2+)を用いています。P4VPMeの過剰存在下では、ZnTPPSは自己集合せず、単一分子として存在し、PETを促進します。この条件下では、P4VPMeはZnTPPSとMV2+間の基底状態電荷移動複合体の形成を阻害し、主要なPET過程をシングレット状態からトリプレット状態へ移行させます。単独のZnTPPSに比べて、P4VPMeの過剰な状況下でのZnTPPSは、MV2+の光誘起酸化に対する触媒活性を10倍以上向上させることが示されました。
抗ビナフチル抗体とビイソキノリン型金属錯体の超分子錯体を用いた触媒的不斉C-C結合形成
Chem-Stationにて紹介
Adachi, T.; Harada, A.; Yamaguchi, H. Sci. Rep. 2019, 9, 13551.
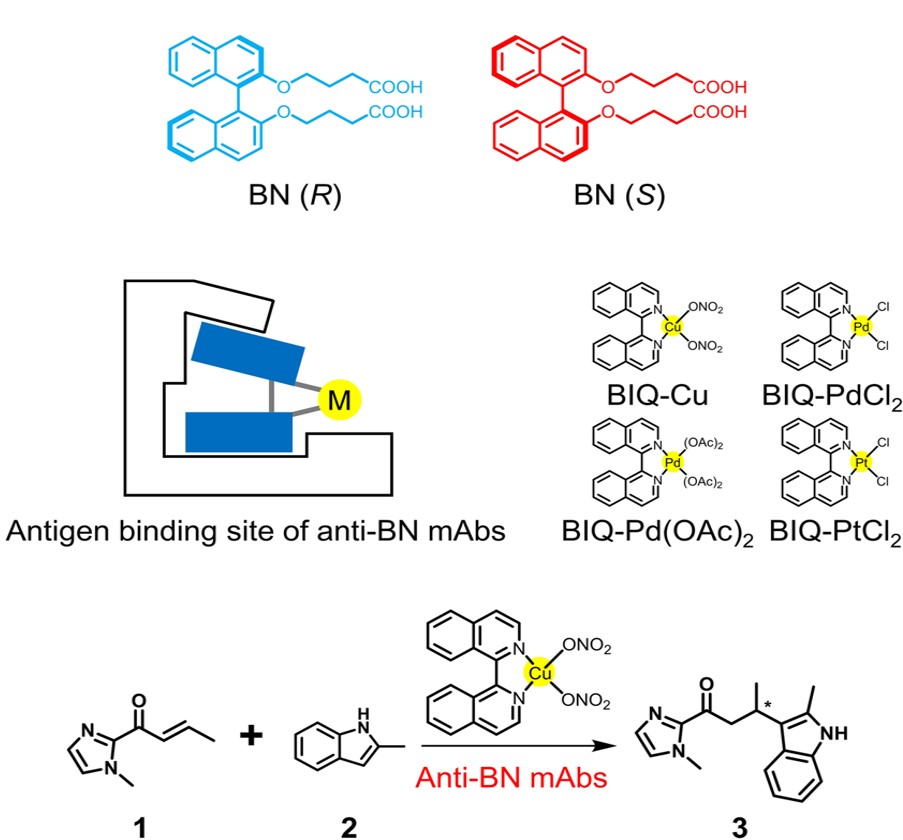
抗BN抗体は1,1’-ビ-イソキノリン (BIQ) を配位子とする数種の金属錯体にも結合した。抗BN 抗体と BIQ を配位子とする銅錯体 (BIQ-Cu) からなる超分子錯体の存在化、フリーデル・クラフツアルキル化反応を行った。BIQ-Cu 単独ではラセミ体の生成物が得られたのに対し、抗体R44E1 存在下では88%のエナンチオ過剰率で反応が進行した。抗体とBIQ-Cu との解離定数に基づいて系中に存在する遊離のBIQ-Cu の寄与を除外すると、超分子触媒は99%以上の極めて高いエナンチオ選択性で反応を触媒していることがわかった。ビナフチル化合物に結合しないモノクローナル抗体やウシ血清アルブミン (BSA) 存在下ではこのような選択性は見られなかった。モノクローナル抗体が形成する特異なタンパク質空間に金属錯体を取り込むことにより、不斉が誘起されたと考えられる。これは抗体を用いた人工金属酵素では初めてのC-C 結合形成反応である。また、抗BN 抗体との超分子形成により従来はキラル構造の不安定さのために困難だったBIQ型金属錯体の不斉触媒化にも初めて成功した。
パラジウム錯体とモノクローナル抗体からなる超分子触媒による不斉アリルアミノ反応
Kobayashi, Y.; Murata, K.; Harada, A.; Yamaguchi H. Chem. Commun. 2020, 56, 1605-1607.
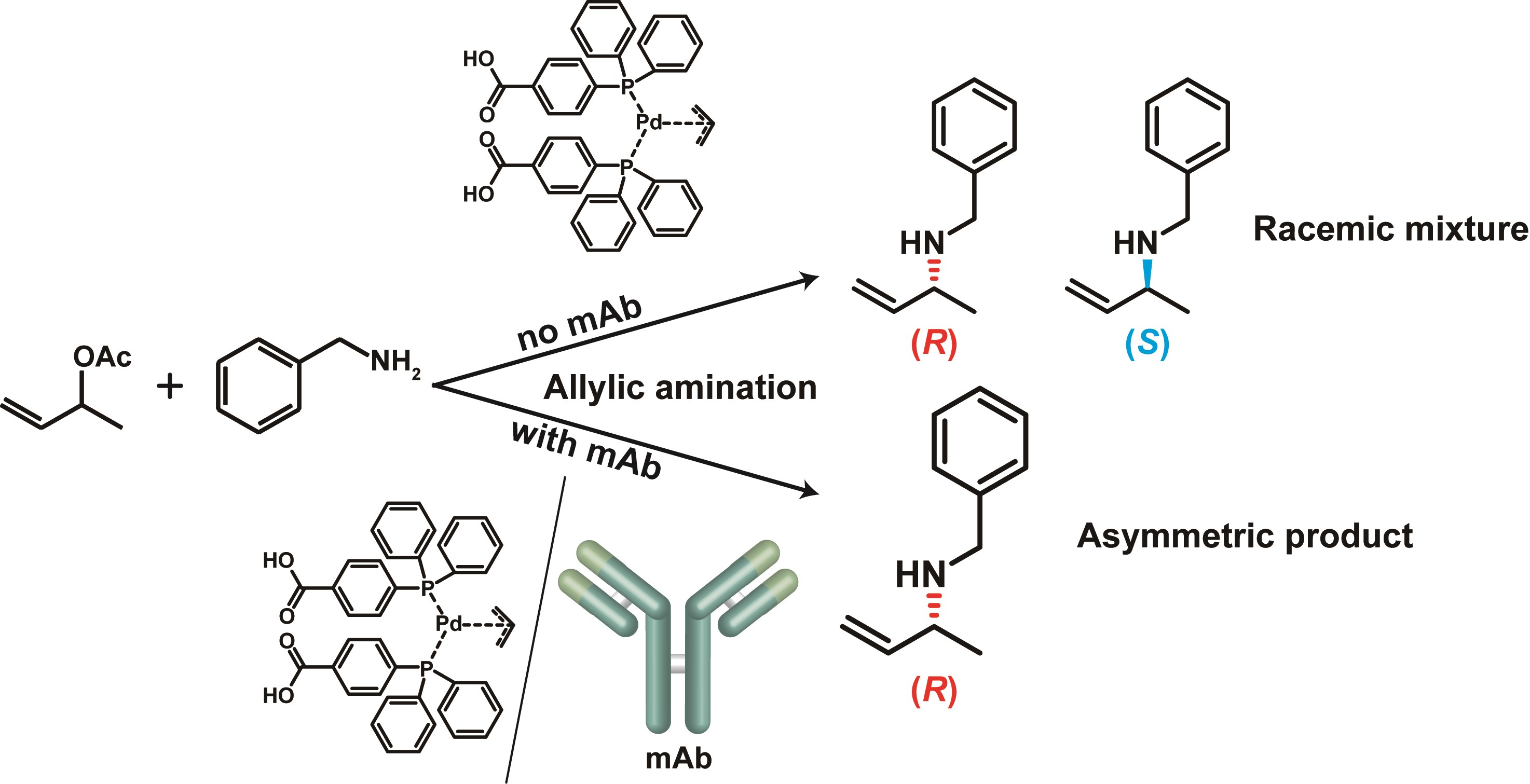
生体内に存在しない遷移金属錯体を特異的に認識するタンパク質を用いれば、その遷移金属錯体-タンパク質複合体は遷移金属錯体単体では見られないような、新規機能を付与することができると期待される。遷移金属錯体を取り込む鋳型タンパク質を第二配位圏として利用することにより、基質選択性や立体特異性が発現されると考えられる。本研究では優れた分子認識能を有するテーラーメイドのタンパク質「抗体」を、遷移金属錯体としては各種クロスカップリング反応などの有用な反応の触媒として広く用いられている「パラジウム(Pd)錯体」を用いた。Pd錯体は水中で不安定であり、免疫中に分解してしまう。そのため、Pd錯体と結合可能なモノクローナル抗体は、Pd錯体と同様のリガンドを持つロジウム錯体を免役することにより、モノクローナル抗体の交差反応性を利用して作製した。Pd錯体モノクローナル抗体からなる超分子触媒は、アリル位アミノ化反応を触媒し、(R)-エナンチオマーのみを選択的に生成した。
ヒドロゲルを用いた酵素反応制御(名古屋大学大学院理学研究科の荘司長三教授との共同研究)
Kobayashi, Y.; Kohara, K.; Kiuchi, Y.; Shoji, O.; Yamaguchi, H. Chem. Commun., 2020, 56, 6723-6726.
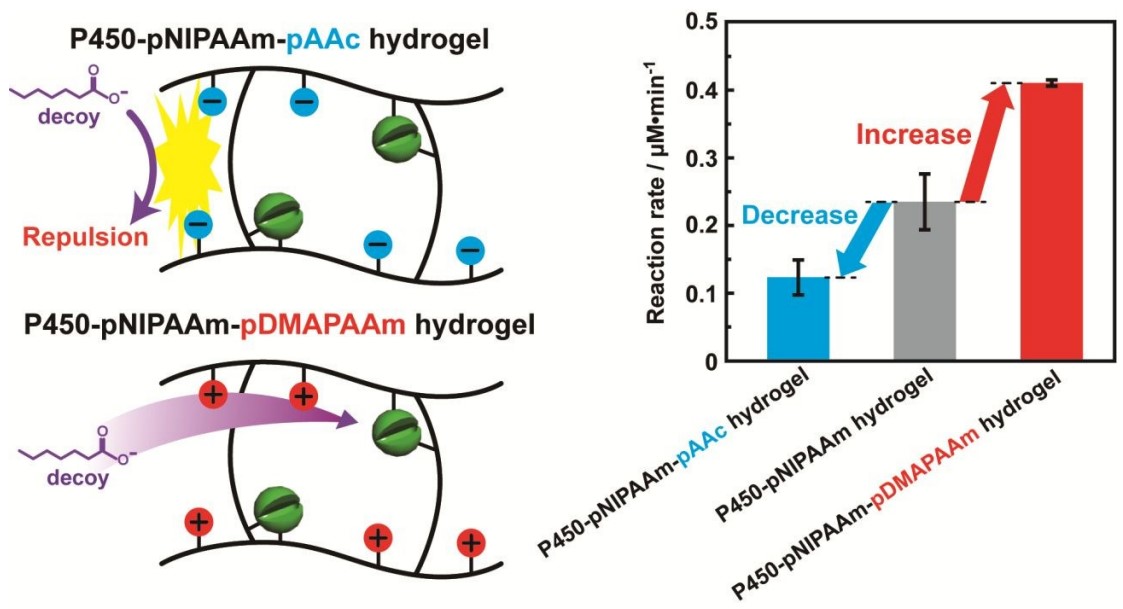
シトクロムP450は、脂肪酸を典型的な基質として位置選択的にヒドロキシ化する酵素であるが、低級脂肪酸(デコイ分子)を系中に添加することで非天然基質に対してもヒドロキシ化する触媒となる。本研究では、P450を架橋密度や様々なポリマー主鎖を持つゲル中に導入することでその触媒活性にどのような影響を持つか調査した。ヒドロゲルの架橋密度の上昇に伴い、触媒を担持したヒドロゲルの基質の酸化速度が上昇した。また、その酸化速度はヒドロゲル中にデコイ分子との相互作用部位を導入することでコントロールすることが可能となった。
硫黄ポリマーを線状分子としたポリロタキサン
Tech Manageにて紹介
Kobayashi, Y.; Harada, A.; Yamaguchi H. Chem. Commun. 2020, 26, 13619-13622.
硫黄は原油の精製過程で産出され、その使用用途も限られているために地上投棄されている余剰資源であり、有効活用する方法の開発が望まれている。その方法の一つとして硫黄を原料としたポリマー材料の開発が進められているが、硫黄を加熱するのみという合成の容易さに反し、溶媒に不溶であり、且つ硫黄ポリマー合成の過程で解重合が起きることから加工性、安定性、機械特性が乏しく、材料への応用が困難であった。これらの問題解決のために、硫黄とビニルモノマー又は多官能性のビニルモノマーとを共重合する方法が開発されている(Polym. Chem. 2019, 10, 4078)。これにより、汎用有機溶媒への溶解性や安定性を獲得したが、溶解性と安定性の両者を兼ね備えた硫黄ポリマーは未だ報告されていなかった。本研究では、硫黄ポリマーの問題解決に共重合や架橋など高分子化学の手法が用いられている中、世界で初めて超分子の概念を用いて溶解性と安定性の両者を兼ね備えた硫黄ポリマーを合成した。具体的には、硫黄ポリマーを環状分子で被覆した、超分子硫黄ポリマー(硫黄ポリロタキサン)を合成し、高分子量であり、そして安定性と加工性を兼ね備えた硫黄ポリマーを報告した(図1 最下段)。特に安定性の向上は著しく、一般的な硫黄ポリマーは大気下で室温では2週間で分解してしまうのに対し、硫黄ポリロタキサンは硫黄ポリマーが環状分子で被覆されているため、8ヶ月以上安定であり、熱安定性も40 °Cも向上した。
金属-リガンド相互作用を用いた超分子硫黄ポリマー
Yamagishi, Y.; Kobayashi, Y.; Horiguchi, A.; Kitano, D.; Yamaguchi, H. ChemistrySelect, 2022, 7, e202103991.
硫黄ポリマーを線上分子としたポリロタキサンの研究により、硫黄ポリマーへの超分子の概念は硫黄ポリマーの問題解決だけでなく、機能化へも有効であることが示された。本研究では、新たな超分子硫黄ポリマーとして、直鎖硫黄の両端に非共有結合部位を導入したモノマーを作成し、そのモノマーを非共有結合にて連結することで、直鎖型の超分子硫黄ポリマーを合成した。得られた硫黄ポリマーはこれまで報告されている一般的な硫黄ポリマーの分子量と比較して大きな分子量を示した。加えて、非共有結合の形成-解離が可逆な点を利用することで硫黄ポリマーの刺激によるポリマー形成-モノマーへの分解をコントロールできた。
水素結合を用いた超分子硫黄ポリマー
Tech Manageにて紹介
Kobayashi, Y.; Yamagishi, Y.; Nishimura, R.; Xiao, C. L.; Kitano, D.; Horiguchi, A.; Hashimoto, S.; Yamaguchi, H. J. Sulfur Chem., 2023, 44, 406-415.
本研究では、新たな直鎖型超分子硫黄ポリマーとして、直鎖硫黄の両端に水素結合部位を導入したモノマーを作成し、そのモノマーを水素結合にて連結することで、水素結合にて連結された直鎖型の超分子硫黄ポリマーを合成した。加えて、水素結合をトリフルオロ酢酸を用いて解離、そのトリフルオロ酢酸を除去することで水素結合を再形成させることで、硫黄ポリマーを化学刺激でポリマー形成-モノマーへの分解をコントロールできた。
金属-リガンド相互作用によって架橋された超分子硫黄ポリマー
Kobayashi, Y.; Kitano, D.; Nishimura, R.; Yamagishi, Y.;Horiguchi, A.; Yamaguchi, H. Polym. Chem., 2023, 14, 2577-2580.
世界で初めて硫黄ポリマーの側鎖間を非共有結合(金属-リガンド相互作用)にて架橋した超分子架橋硫黄ポリマーを合成した。得られた超分子架橋硫黄ポリマーの分子量は、従来の高分子合成法によって得られる硫黄ポリマーの分子量よりも29倍高いことが分かりました。キレート剤および金属イオンの添加により、超分子架橋硫黄ポリマーの分解および形成を制御出来ることも分かりました。超分子架橋硫黄ポリマーの熱安定性は通常の硫黄ポリマーよりも高いため、硫黄ポリマー材料への応用が期待されます。
擬ポリロタキサンを利用した高濃度での環状ポリマー合成
Tsuji, Y.; Kobayashi, Y.; Chunlin, X.; Harada, A.; Yamaguchi, H. Chem. Lett., 2022, 52, 1-4.
Xiao, C.-L.; Kobayashi, Y.; Tsuji, Y.;Harada, A.; Yamaguchi, H. ACS Macro Lett., 2023, 12, 1498-1502.
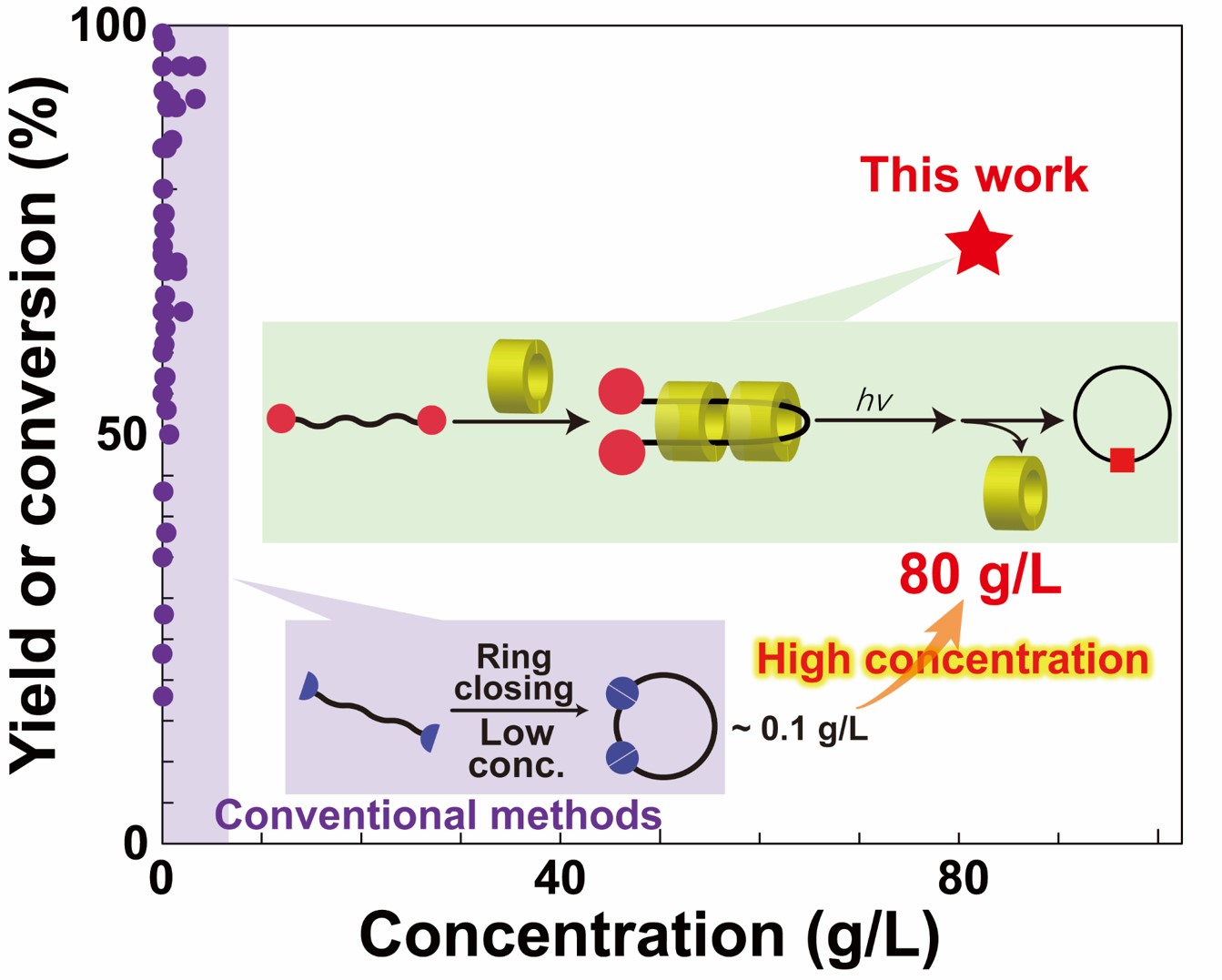
環状ポリマーは他の形状のポリマーとは異なる機能・特性を発現する。環状ポリマーの代表的な合成法に、線状ポリマーの両末端を連結させる閉環法がある。しかしこの方法で環状ポリマーを得るためには、線状ポリマーの伸長反応を抑制するために低濃度で反応させる必要がある。そのため、環状ポリマーの量産のために高濃度でも選択的に環状ポリマーが得られる方法論の構築が望まれている。 本研究では、γシクロデキストリンがポリエチレングリコールを二本分貫通させた擬ポリロタキサン(pPRx)を形成することを利用して、高濃度ポリマー溶液から環状ポリマーを得る方法を開発した。pPRx形成を用いない場合では環状ポリマーがほとんど得られない(収率1%未満)高濃度条件下でも、pPRx形成を用いることで環状ポリマーの収率を向上(14%)させることができた(Chem. Lett.)。 その後、末端基と環状分子を適切二選択することにより、収率を70%にまで向上することができた(ACS Macro Lett.)。