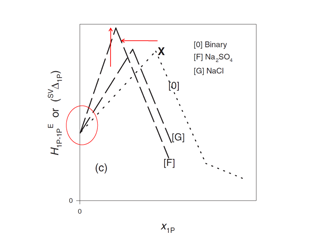
 Fig. 1. Effects of sodium salts on the concentration dependence pattern of HE1P–1P.
Fig. 1. Effects of sodium salts on the concentration dependence pattern of HE1P–1P.水溶液中の分子やイオンの性質を調べる方法の一つに 1P–Probing 法があります.この方法は,対象となる分子やイオンを含む1–プロパノール(1P)水溶液中において 1P の過剰部分モルエンタルピー HE1P を測定し,その濃度微分量 HE1P–1P を図上微分により求めます.混合水溶液中で水がまだ“水らしさ”を保つ限り,HE1P–1P の 1P 濃度依存性はピーク型の異常を示します.そのピーク位置(X点)が対象とする分子や塩を加えることによりどのようにシフトするかについて考察することで,目的の分子やイオンの水溶液中での性質を調べようというものです.この方法を使って,クエン酸ナトリウムの水に対する影響を調べました.
 Fig. 1. Effects of sodium salts on the concentration dependence pattern of HE1P–1P.
Fig. 1. Effects of sodium salts on the concentration dependence pattern of HE1P–1P.
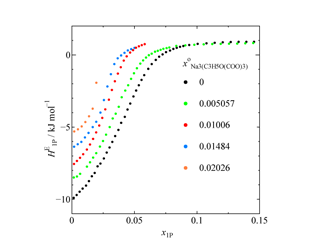 Fig. 2. Concentration dependence of HE1P in sodium citrate aqueous solution.
Fig. 2. Concentration dependence of HE1P in sodium citrate aqueous solution.
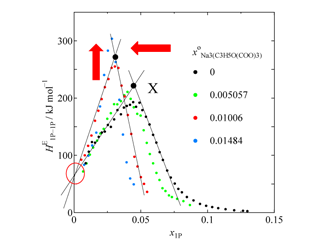 Fig. 3. Concentration dependence of HE1P–1P in sodium citrate aqueous solution.
Fig. 3. Concentration dependence of HE1P–1P in sodium citrate aqueous solution.
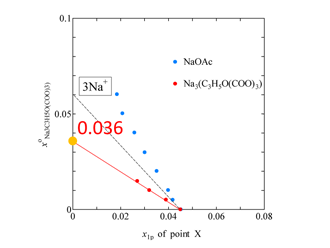 Fig. 4. The value of x1P of point X vs. initial concentration of sodium citrate aqueous solution. Dotted line shows the contribution of three sodium ions.
Fig. 4. The value of x1P of point X vs. initial concentration of sodium citrate aqueous solution. Dotted line shows the contribution of three sodium ions.
電解質を試料とした場合,疎水的な非電解質の場合と異なる HE1P–1P の濃度依存性を示します(Fig. 1).塩化ナトリウムや硫酸ナトリウムの場合,X点は図上左向きにシフトします.つまり,水和殻ができて 1P と関わりをもつ水分子が減ったことを意味します.同時に,塩化ナトリウムの場合,x1P = 0 付近では溶質付加による HE1P–1P の変化は見られないという結果になっています.これは塩化ナトリウム付加による影響がバルクの水分子に及ばないことを意味しています.一方,硫酸ナトリウムの場合は,それと同時にX点の上向きのシフトが見られます.詳細はわかっていませんが,おそらく疎水性の中性分子がそうであるように,水和殻の外側にあるバルクの水の水素結合確率が 1P が増加するにつれて下がっていくのだろうと推測されます.これらを踏まえて,クエン酸ナトリウムの水に対する影響を調べました.
装置は酢酸ナトリウムと同様に,研究室既設の自動化された Thermometric 社製等温壁型熱量計 LKB8700 を使用しました.測定はヒーターでの加熱による熱容量測定(Calibration)と,1P 滴下の際の熱変化測定(Titration)を交互に繰り返す形で,x1P = 0 ~ 0.15 の濃度領域で行いました.前後の Calibration で求めた熱容量をもとに,Titration での熱変化を HE1P に換算しました.
クエン酸ナトリウムの HE1P 測定結果(Fig. 2)と HE1P–1P 計算結果(Fig. 3)を示します.x○Na3(C3H5O(COO)3) ≥ 0.01 では終点付近で相分離が観測されたので,その時点で測定を中止しました.Fig. 3 からわかるように,X点は全般に左向きならびに上向きにシフトしています.これはクエン酸イオンが疎水的であり,かつ硫酸イオンと同様の水和メカニズムをとることを示しています.一方で,x1P = 0 付近では HE1P–1P の値にほとんど変化は見られません.このことからクエン酸イオンは硫酸ナトリウムと同様の影響を与えることがわかりました.さらに,水和殻のサイズを調べるために,X点のx座標の塩濃度依存性をプロットした図を示します(Fig. 4).水和水を求める定法に従って,このプロットを x1P = 0 に補外した値 x○Na3(C3H5O(COO)3) = 0.036 が水分子とイオンのモル分率に当たるとの考えから,イオン周りの水分子の数を26.8個と見積もることができました.ナトリウムイオンの周りには5.2個の水分子が水和しているといくつかの研究で報告されていることから,ナトリウムイオン3個分である15.6個を差し引くと,クエン酸イオンの周りの水分子の数は11.2個と見積もられます.
結論として,クエン酸イオンは水溶液中で硫酸イオンと同様の挙動を示し,周りに11.2個の水分子をもつ水和殻を形成すること,そして 1P の増加につれてバルクの水の水素結合確率が減少していくのではないかということが示唆されました.
近藤洸生,宮崎裕司,稲葉 章,古賀精方,第46回熱測定討論会(津),P19 (2010).