
高島 義徳(TAKASHIMA, Yoshinori)
| 所属・職名 | 大阪大学 高等共創研究院・教授 大阪大学 大学院 理学研究科 高分子科学専攻・教授 (兼任) |
||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| takasima<at>chem.sci.osaka-u.ac.jp <at>は@に変換 | |||||||||||||||||
| 経歴 |
|
||||||||||||||||
| 学位 | 博士(理学)(大阪大学)(2003年03月) | ||||||||||||||||
| 受賞歴 | 2008年04月 日本化学会 優秀講演賞(学術) 2009年05月 高分子学会 高分子研究奨励賞 2010年09月 日本化学会主催 第4回バイオ関連化学シンポジウム講演賞 2011年09月 平成23年度シクロデキストリン学会奨励賞 2012年07月 第58回高分子研究発表会ヤングサイエンティスト講演賞 2014年04月 文部科学大臣表彰若手科学者賞 2016年06月 HGCS Japan Award of Excellence 2016 |
||||||||||||||||
| 所属学会 | 日本化学会,高分子学会、シクロデキストリン学会、生体機能関連部会 | ||||||||||||||||
| 専門分野 | 高分子化学・超分子科学・金属触媒重合 |
trans-スチルベン β-CDダイマーとゲストダイマーを用いて可逆的に超分子錯体の構造制御が試みられた。D2O中で両者を混合すると超分子錯体形成が示唆され、得られた錯体に350nmの光照射を行ったところ、Stilbeneの異性化が観察された。光照射前後の超分子錯体の分子サイズは光照射前の方が拡散係数が大きく(分子サイズが小さい)、光照射後には濃度に依存して拡散係数の減少が観測された。このことから、光照射前には挟み込み型の超分子ダイマーを形成し、光照射後には超分子ポリマーに変化する超分子錯体系の構築に成功した。
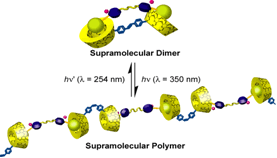
光刺激による超分子構造体の構造変化
Kuad, P.; Miyawaki, A.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"External Stimulus-Responsive Supramolecular Structures Formed by a Stilbene Cyclodextrin Dimer"
J. Am. Chem. Soc. 2007, 129(42), 12630-12631.
α-CDの3位にゲスト分子としてtrans-スチルベン を1 つ導入した修飾α-CDを用いて超分子錯体を形成し、その超分子の構造制御に成功した。trans-スチルベン 修飾α-CDは水溶液中は差し違いダイマーを形成していることが単結晶X線構造解析により明らかとなった。さらに光照射によってcis化したcis-スチルベン 修飾α-CDは濃度変化1H-NMR測定の結果からスチルベン部位のピークシフトが観測され、CDスペクトル測定によりカップリングが観測された事から、分子間で超分子を形成していることが示唆された。しかし2D ROESY NMR測定からはスチルベンとα-CDの内部のプロトンとの間に相関は観測されず、trans体とは異なり、cis体は包接を介さずスチルベン同士がスタックした超分子を形成していることが示された。 このように光により超分子錯体の構造制御が可能である事が明らかとなった。
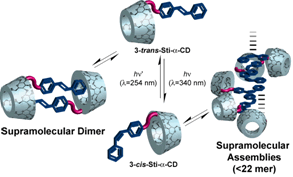
スチルベン 修飾α-CDにより形成された超分子錯体の光構造制御
Yamauchi, K.; Takashima, Y.; Hashidzume, A.; Yamaguchi, H.; Harada, A.
"Switching between Supramolecular Dimer and Non-Threaded Supramolecular Self-Assembly of Stilbene Amide alpha-Cyclodextrin by Photoirradiation"
J. Am. Chem. Soc.2008, 130(15), 5024-5025.
CDにアルキル鎖を修飾した化合物を軸分子としロタキサンを合成した。従来のロタキサンでは輪分子のシャトリングは軸分子と輪分子の相互作用により制御されていたが、本系では軸分子のCDがストッパーとして単に嵩高いだけでなく、軸分子を取り込む機能を利用して、輪分子のシャトリングの変化を観察した。
その結果、 [2]ロタキサンでは、メタノールおよびDMSO-d6中でローターはアルキル鎖を包接していた。一方、水中では、ローターはスチルベン部位を包接し、ストッパーのCDの一部のユニットが宙返り(タンブリング)を起こし、アルキル鎖を包接していた。従来のシャトリングの制御方法として、軸分子とローターの相互作用によりシャトリングを制御するものであった。本系ではローターにCDを、ストッパーとして単に嵩高いだけでなく、軸分子を巻き取る機能を利用して、ロタキサンのシャトリングの制御することに成功した. (図1)
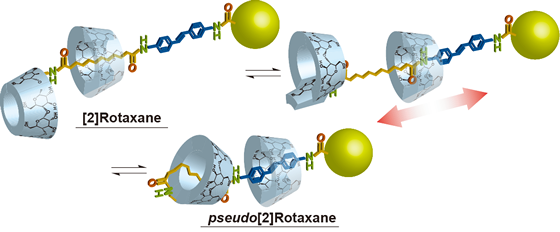
図1. 末端のCDの宙返りを利用した輪分子のシャトリング制御 .
Yamauchi, K.; Miyawaki, A.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"A Molecular Reel: Shuttling of a Rotor by Tumbling of a Macrocycle"
J. Org. Chem. 2010, 75, 1040-1046.
超分子化学の発展と伴に様々なホスト化合物が世の中に登場した。カリックス[n]アレーンはCDと並ぶ代表的なホスト化合物であり、そのユニットは宙返り(タンブリングまたはフリップ)することが知られている。CDも水酸基をメチル化された化合物は宙返りすることが報告されている。一方で未修飾のCDはグルコピラノース間の水素結合形成により、グルコピラノースは宙返りしないと考えられてきた。私たちはCDの直近に柔軟なアルキル鎖を修飾したαCD ダイマーの構造についての詳細な検討を行った。
この結果はアルキル鎖がCD空洞内に引き込まれ包接錯体を形成したのではなく、グルコピラノースユニットの宙返りによって実現されたpseudo[1]ロタキサンダイマーであると考えられる。速度論的解析の結果、宙返りの速度は6.58?10-4 s-1 (288 K)であり?Go = -8.1 kJ?mol-1 (288 K) であることが明らかと成った。また非包接状態のαCD ダイマーから包接状態のpseudo[1]ロタキサンダイマーへの構造変化には高い活性化自由エネルギー(?G‡288K = 88.0 kJ?mol-1)を必要とする。これは、αCDが持つ水酸基間の水素結合を切断し、グルコピラノースユニットの宙返りするのに必要なエネルギーであると考えられる. (図2)
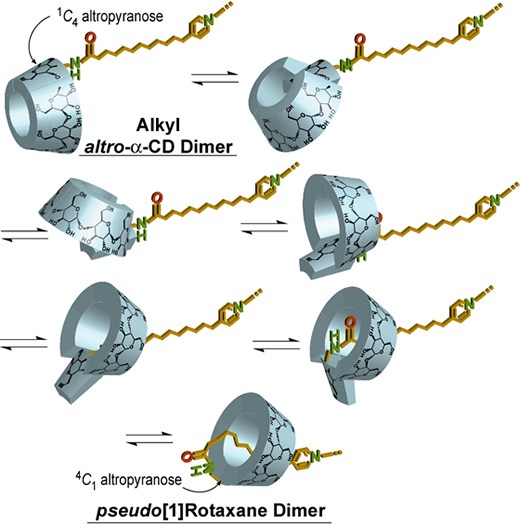
図2. 長鎖アルキル基により架橋されたCDダイマーのグルコピラノースユニットの回転運動を通した
[1]ロタキサンダイマーの形成
Yamauchi, K.; Miyawaki, A.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"Switching from altro-α-Cyclodextrin Dimer to pseudo[1]Rotaxane Dimer through Tumbling"
Org. Lett. 2010, 12, 1284-1286.
CDの二級水酸基の置換位置により、形成される超分子錯体の構造が異なるのではないかと考え、桂皮酸をα-CDの二級水酸基の2位または3位にエステル結合にて導入し、超分子錯体形成挙動について調査した。
その結果、2位または3位に修飾された桂皮酸エステルが転位反応を示すだけでなく、単独状態と混合状態により形成される超分子錯体が異なるといった興味深い挙動を示した。
![広い口側の二級水酸基にゲスト分子が修飾されたCDによるポリ[2]ロタキサン合成](images/Social_self_sorting.gif)
Tomimasu, N.; Kanaya, A.; Takashima,Y.; Yamaguchi, H.; Harada, A.
"Social Self-Sorting: Alternating Supramolecular Oligomer Consisting of Isomers"
J. Am. Chem. Soc. 2009, 131(34), 12339-12343.
単糖におけるアシル基転位反応は広く知られているが、α-D-グルコースを構成ユニットにもつ環状オリゴ糖であるシクロデキストリン(CD)のアシル基転位反応についての詳細な報告はない。本研究ではアシル基としてαCD と会合定数の高いスチルベンをその二級水酸基に導入したところ、アシル基の転位反応によって生じる化合物のそれぞれが異なる超分子錯体を形成していることが明らかとなった。さらに今回、スチルベンの異性体に応じて転位速度が異なり、この速度が超分子構造に影響を受けていることを観察した。
超分子錯体形成によってアシル基の転位反応が抑制されることが示された。そこで、形成される超分子錯体の構造を調べるために2D ROESY NMR 測定を行ったところ、2-StiO-αCD と3-StiO-αCDの混合溶液中においても同じ異性体同士(2-StiO-αCD 同士、及び3-StiO-αCD 同士)でホモ超分子錯体形成をすることが明らかとなった(図1).
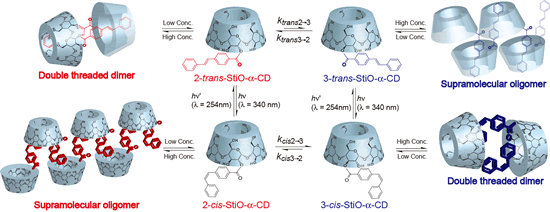
Kanaya, A.; Takashima, Y.; Harada A.
"Double Threaded Dimer and Supramolecular Oligomer Formed by Stilbene Modified Cyclodextrin ? Effect of Acyl Migration and Photo Stimuli"
J. Org. Chem., 2011, 76, 492-499.
CDの超分子錯体にて動的挙動を観察するために、桂皮酸修飾部位をアルキル鎖にて伸張した修飾CD合成し、水中にて挿し違い型ロタキサンダイマーを形成させた。その後、ストッパー分子を導入し、有機溶媒中においても解離しない挿し違い型ロタキサンダイマーを得ている。その伸縮挙動は溶媒極性の変化によりCDの包接位置が変化した。
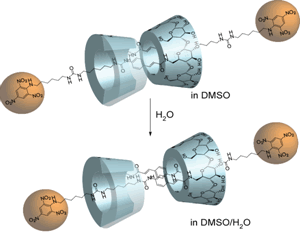
図1.溶媒の極性変化により、収縮するロタキサンダイマー
Tsukagoshi, S.; Miyawaki, A.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"Contraction of Supramolecular Double-Threaded Dimer Formed by alpha-Cyclodextrin
with a Long Alkyl Chain"
Org. Lett. 2007, 9(6), 1053-1055.
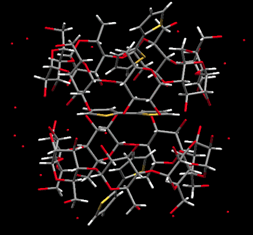
Polythiophene (PT) は有機半導体の中でも広く利用されており、分子被覆導線としてCDを用いたポリロタキサン形成に有効である。オリゴマーであるBithiophene (2T) は、β-CD, hydroxylpropyl-β-CD, 2,6-O-dimethyl-β-CDと1:1錯体を形成し、 [2]ロタキサン構造を形成した。
| (a) | (b) |
 |
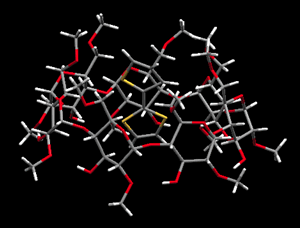 |
| β-CD (a)と2,6-O-dimethyl-β-CD(b)の2T包接錯体の結晶 | |
カップリング反応を利用すると、2,6-O-Dimethyl-β-CD(DM-β-CD)と2TよりPolythiopheneを軸分子としたポリ擬ロタキサンが形成した。
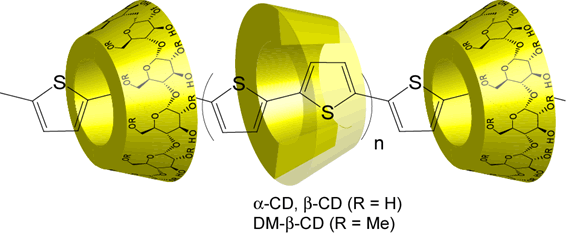
Polythiopheneを軸分子としたポリロタキサン
Takashima, Y.; Sakamoto, K.; Oizumi, Y.; Yamaguchi, H.; Kamitori, S.; Harada, A.
"Complex Formation of Cyclodextrins with Various Thiophenes and Their Polymerization in Water: Preparation of pseudo-Polyrotaxanes Containing Poly(thiophene)s"
J. Incl. Phenom. Macrocycl. Chem. 2006, 56(1-2), 45-53.
オリゴチオフェン誘導体の両末端にβ-シクロデキストリン (β-CD)を修飾したポリロタキサンを作成した。β-CDの修飾によりオリゴチオフェンは水に溶解し、DM-β-CDの包接数、軸部分の鎖長が厳密に定まり、ロタキサンの特性評価が容易になった。
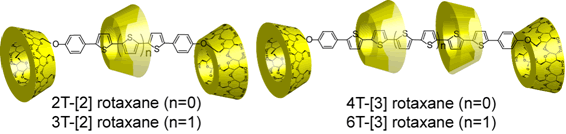
Sakamoto, K.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"Preparation and Properties of Rotaxanes Formed by Dimethyl-beta-cyclodextrin and Oligo(thiophene)s with beta-Cyclodextrin Stoppers"
J. Org. Chem. 2007, 72(2), 459-465
近年、共役分子はその発光特性や電気的な性質から大きな注目を集めており、多くの研究がなされている。しかし、その特性を十分に発揮させるには高次構造の精密制御が必須となる。私たちはπ共役分子の構造制御を超分子科学的な手法を用いて行うため、CDと共役分子の組み合わせによる構造制御について検討してきた。本研究では、ロタキサンの末端 βCD 部位を利用し、ゲスト分子との混合系について、超分子形成とエネルギー移動について検討した。
ホストとして末端にゲスト分子を包接可能なβCD 部位を有する2T-[2]ロタキサンおよび 3T-[2]ロタキサンを、ゲスト分子には、水溶性を有し、CDに包接される形状のオリゴチオフェン誘導体Disodium salt of 2,2':5',2'':5'',2''': 5''',2'''':5'''',2'''''-sexithiophene-3'',4'''-dicarboxylic acid (6TCA2Na2) を合成した. (図1)
![Polyethylene glycolとヒドロ桂皮酸を有する-CDの[1]ロタキサン形成(a)と[1]ロタキサンの光構造制御(b)](images/fig01-8-1.png)
図1. 2T-[2]rotaxaneと6TCA2Na2の混合溶液の発光挙動とこれらの溶液を石英板に乾燥させたときの発光挙動.
6TCA2Na2は単体では強い発光を示さないが、6TCA2Na2とロタキサンを混合すると強い発光を示し、6TCA2Na2単体を直接励起 (λex = 424 nm) した場合よりも強い発光であった(図19)。これはロタキサンをドナー、6TCA2Na2をアクセプターとしたエネルギー移動が起こったと考えられる。更にロタキサン部位の発光の減少の度合いからエネルギー移動効率を算出すると、90 %以上の高効率であることがわかった。一方で競争ゲストを過剰量添加した場合、混合系の蛍光スペクトルでは6TCA2Na2由来の発光が減少した。これはロタキサンと6TCA2Na2の錯体形成が阻害されたためと考えられる。これらの溶液を石英板上に塗布し、乾燥させると、より明確に発光強度の差が観察された。6TCA2Na2単体では自己消光されて、全く発光しないが、ロタキサンと6TCA2Na2の混合物は鮮やかな蛍光発光を示し、固体状態においても、効率よくエネルギー移動が起こった. (図2)
![Polyethylene glycolとヒドロ桂皮酸を有する-CDの[1]ロタキサン形成(a)と[1]ロタキサンの光構造制御(b)](images/fig01-8-2.png)
図2. ホスト分子として機能する2T-[2]rotaxane および 3T-[2]rotaxaneの化学構造とゲスト分子として機能する6TCA2Na2の化学構造.
Sakamoto, K.; Takashima, Y.; Hamada, N.; Ichida, H.; Yamaguchi, H.; Yamamoto, H.; Harada, A.
"Selective Photoinduced Energy Transfer from a Thiophene Rotaxane to Acceptor"
Org. Lett. 2011, 13, 672-675.
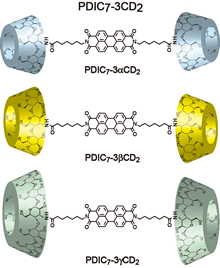 |
| 図3.ジアルキル置換ペリレンジイミド修飾CDの化学構造 |
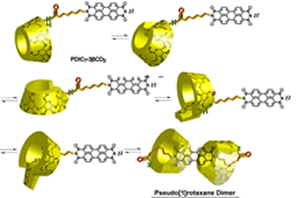 |
| 図4.アルトロピラノースユニットの回転運動を通したPDIC7-3?CD2 の超分子構造の変化. |
 |
| 図5.PVAフィルムに溶かし込んだPDIC7-3CD2の発光挙動.(上部) 可視光下、(下部) UV 照射下 (λex = 365 nm). |
近年、ジアルキル置換ペリレンジイミド化合物は有機電界効果トランジスタ(OFETs)などに代表される光電子材料や蛍光センサーとして期待されている。一方でペリレンジイミド化合物(PDIs)は一部の有機溶媒には溶解するものの、多くの有機溶媒に不溶であり、水や極性溶媒に対する溶解度は極めて低い。私たちはPDIの発光特性とシクロデキストリン(CD)の分子認識能を生かした効率の良い発光フィルムを合成し、その発光特性について調べた。
各種PDI-CDダイマーとポリビニルアルコール (PVA) 水溶液を混合、乾燥させたところ、CDの空孔サイズに応じた特異的発光特性を示すフィルムが得られ、特にPDIC7-3?CD2が強い発光性を示した(図5)。
このフィルム作製は水溶液から行うことが重要で有機溶媒からは発光フィルムは得られず、CDの分子認識能とタンブリングが関係していると考えられる。今後、これらの発光性フィルムは化学物質を検出するフィルムとして応用が可能と考えられる。
"Emission Properties of Cyclodextrin Dimers Linked with Perylenediimide - Effect of Cyclodextrin Tumbling"
Takashima, Y.; Fukui, Y.; Otsubo, M.; Hamada, N.; Yamaguchi, H.; Yamamoto, H.; Harada, A.
Polymer Journal 2012, 44, 278-285.
シクロデキストリン(CD)は、その空孔内部に基質分子を取り込み、基質の起こすエステル加水分解などの反応を触媒することが知られています。これまでに、CDによる酵素触媒モデル系が多く研究されてきましたが、これらの反応は、基質自体に高い反応性や厳しい反応条件が必要であったり、基質に対して大過剰量のCDが必要とされるため、これまで有機合成触媒として利用されることはありません。我々はCDのエステル結合に対する反応性を重合反応に利用できないか?と考え、水中にてポリエステルのモノマーであるラクトンを混合し、反応を行いましたが、ラクトンの加水分解反応が促進または抑制されるのみでした。
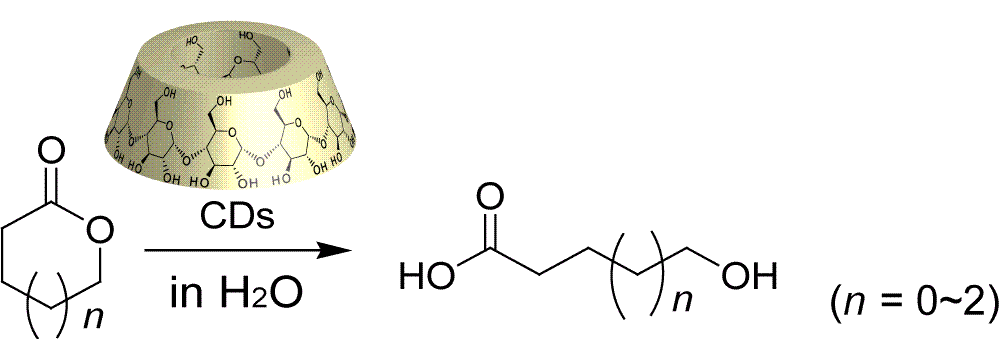
Takashima, Y.; Kawaguchi, Y.; Nakagawa, S.; Harada, A.
"Inclusion Complex Formation and Hydrolysis of Lactones by Cyclodextrins"
Chem. Lett., 2003, 32, 1122-1123.
そこで我々はCDと環状エステルを水のない系で反応させれば、加水分解ではなく、ポリエステルの合成が行えるのではないかと考え、CDによる環状エステルの開環重合を試みました。乾燥したCDにポリエステルのモノマーであるラクトンを固相で混合し、100 oCに加熱することで、高い収率でポリエステルを得ました。従来のラクトンの重合にて用いられる強力な反応性を有する有機試薬を用いなくとも、助触媒も必要とせず、固相中にて混合するだけで重合が進行します。これはCDの空孔が酵素のように反応場となっているため、反応場に取り込まれた分子のみが反応することが明らかとなりました。さらに得られたポリマー鎖はCDに一本のみ結合した構造である事が明らかとなりました。
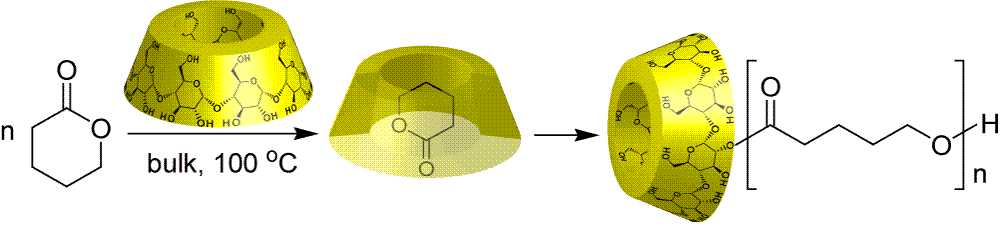
Takashima, Y.; Osaki, M.; Harada, A.
"Cyclodextrin-Initiated Polymerization of Cyclic Esters in Bulk:
Formation of Polyester-Tethered Cyclodextrins"
J. Am. Chem. Soc. 2004, 126(42), 13588-13589.
Osaki, M.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"Polymerization of Lactones Initiated by Cyclodextrins: Effects of Cyclodextrins on the Initiation and Propagation Reactions"
Macromolecules 2007, 40(9), 3154-3158.
CDに光異性化が可能な置換基を導入し、置換基の構造変化によりモノマーの包接を制御することによって重合活性の制御を試みました。置換基である桂皮酸がトランス体の場合、CDはラクトンに対して重合活性を示したのに対し、桂皮酸がシス体の場合、重合活性は大きく抑制されました。これはCDの空孔をシス体の桂皮酸が立体障害となり、モノマーの進入・包接を阻害した為と考えられます。
Osaki, M.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"Switching of Polymerization Activity of Cinnamoyl-alpha-Cyclodextrin"
Org. Biomol. Chem. 2009, 7, 1646 - 1651.
この重合において、活性種であるCDだけでなく、成長したポリマー鎖のコンフォメーションを制御することも重合反応において重要で、生長するポリマー鎖はほかのCDによって包接されていました。このように、生長反応点となるCDとポリマー鎖を包接するCDの2つのCDが重要であることが判りました。まさにポリロタキサンの形成が重合活性に重要である事が明らかとなりました。

Osaki, M.; Takashima, Y.; Yamaguchi, H.; Harada, A.
"An Artificial Molecular Chaperone: Poly-pseudo-rotaxane with an Extensible Axle"
J. Am. Chem. Soc. 2007, 129(46), 14452-14457.
Harada, A.; Osaki, M.; Takashima, Y.; Yamaguchi, H.
"Ring-Opening Polymerization of Cyclic Esters by Cyclodextrins"
Acc. Chem. Res. 2008, 41(9), 1143-1152.
ウイルスの表面は特異的な分子認識部位をもち、球状多層構造を形成している。CDを用いて球状構造を形成できれば、球状分子表面にて重合が行えるのではないかと考え、研究に取り組みました。金ナノ粒子を鋳型にしてCDを修飾し、その後、内部の金ナノ粒子をヨウ素にて溶かし、ジスルフィド結合を形成することにより球状分子を構築しました。金ナノ粒子をコアに有する球状分子はラクトンに対して重合活性を有しませんが、内部が空洞のCD球状分子はラクトンに対する重合活性がある事がわかりました。さらに球状分子表面に生成したポリマー鎖をポリロタキサン構造にすることにより、さらに重合が行える事が明らかと成りました。

CDダイマーを合成し触媒に用いたところ、CDダイマーはCDモノマーより、さらに活性が高く、高分子量のポリマーを生成した。さらにCDを用いた場合、その生成物を精製してさらに重合を試みたところ、活性はみられなかったが、CDダイマーを用いて得られた生成物(ポリマー)を触媒として、さらにモノマーを加えて重合を試みたところ、さらなる重合が進むことを見出した、これはCDダイマーの一方が重合活性点として働きもう一方が生成したポリマーを引き出す役割をしているためであることを見出した。この役割はDNA重合酵素のクランプの働きに酷似している。CDダイマーを用いることにより、分子量が数万のポリエステルを得ることができた(図1)。
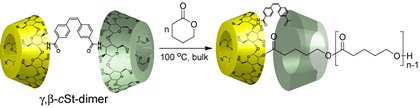
図1:ダイマーによるラクトンの重合
近年、水系での有機反応を行う超分子触媒が求められており、本研究では基質の認識部位および触媒の活性化部位を有する超分子触媒の合成を行い、水中での重合反応を試みた。基質の認識部位としてシクロデキストリン (CD) を基本骨格としたジシクロヘキシルホスフィン配位子を有するルテニウム錯体を合成し、水系での開環メタセシス重合の活性について検討した。
図1に示すようにβCDにホスフィンを結合し、Ruを配位させた化合物を合成し、ノルボルネン誘導体の開環メタセシス重合 (ROMP) を行った。[モノマー]/[触媒] = 100で重合を行ったところ重合反応が進行し、ポリマーが得られた。 有機溶媒中での反応と比べ PCy2-Ru-βCD を触媒として用いた重合では、ポリマーの収率および分子量は向上することがわかった。代表的な ROMP 触媒であるRuCl3・3H2O および RuCl3・3H2Oとtris(3-sulfonatephenyl)phosphine hydrate, sodium salt (TPPTS) との錯体を比較した結果、同条件下での重合反応においても重合反応は進行しなかった。モノマーよりも強く相互作用する競争ゲスト(アルコールやアダマンタンなど)を添加し重合することによって、重合反応の阻害が確認され、 PCy2-Ru-βCDの有するCD部位が重合反応に対して有効に作用することがわかった
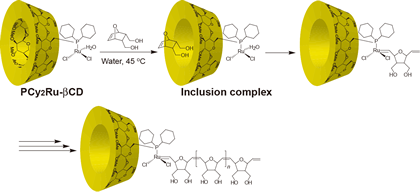
図1.CD-Ru ホスフィン触媒を用いた7-オキソノルボルネンジメタノールの開環メタセシス重合
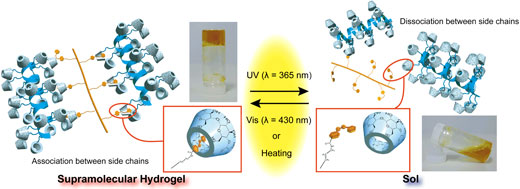
α-シクロデキストリン (αCD) とアゾベンゼン (Azo) との組み合わせにより、光でゾル-ゲルの制御が可能なヒドロゲルの構築を行った。 CD 修飾カードラン (CD-CUR) と Azo 修飾ポリアクリル酸 (pAC12Azo) を水中で混合し、ヒドロゲルを形成した。 ポリマー側鎖として修飾した CD と Azo の多点相互作用によりヒドロゲルが形成されたと考えられる。
形成したヒドロゲルへ CD と Azo の間の包接錯体形成を阻害する分子を添加する実験を行った。競争ホスト/競争ゲスト分子を混合した場合、形成されたゲルはゾルの状態へと変化し、大幅な粘度の減少が確認された。この結果より、ポリマー側鎖の CD と Azo の相互作用によりゲル形成が生じたと判断した。
光刺激に対するゲルの応答性を調べるため、ヒドロゲルへ紫外光の照射を行った。その結果、粘度の減少が確認され、ゾル状態へ変化した。逆に可視光を照射したところ、粘度は再び回復しゲル化した。この挙動は繰返し発現し、光で制御可能な自己修復材料への展開が期待できる。
Tamesue, S.; Takashima, Y.;Yamaguchi, H.; Shinkai, S.; Harada, A., Angew. Chem. Int. Ed. 2010, 49, 7461.
酸化・還元刺激応答性の自己修復性超分子ヒドロゲルを作製するにあたり、ホスト分子として β-CD、ゲスト分子としてフェロセン (Fc) を選択した。β-CD はその空洞に Fc のサイズがフィットするために安定な錯体を形成する。 Fc は還元状態では CD と包接錯体を形成するが、酸化状態の Fc+ では CD と包接錯体を形成しないことが明らかとなっている。今回の実験では β-CD を側鎖に修飾したホストポリマーと Fc を側鎖に修飾したゲストポリマーを用いて、刺激応答性自己修復材料を作製した。合成したそれぞれのポリマーを水に溶かし、それらの溶液を均一に混ぜ合わせると、混合溶液は固まり、流動性のない安定なゲルが形成された。
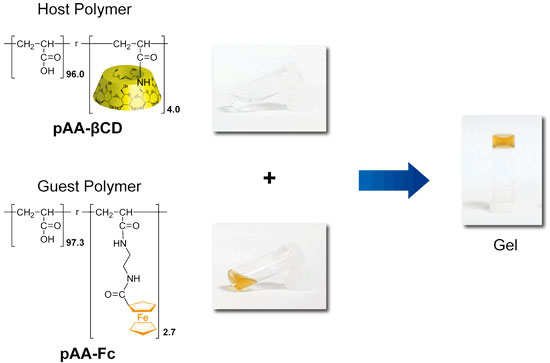 |
| 図1. シクロデキストリンを高分子側鎖に結合させたホストポリマーとフェロセンを結合させたゲストポリマーの構造、それらの水溶液の混合によるゲル形成 |
水溶液混合による素早いゲルの形成 |
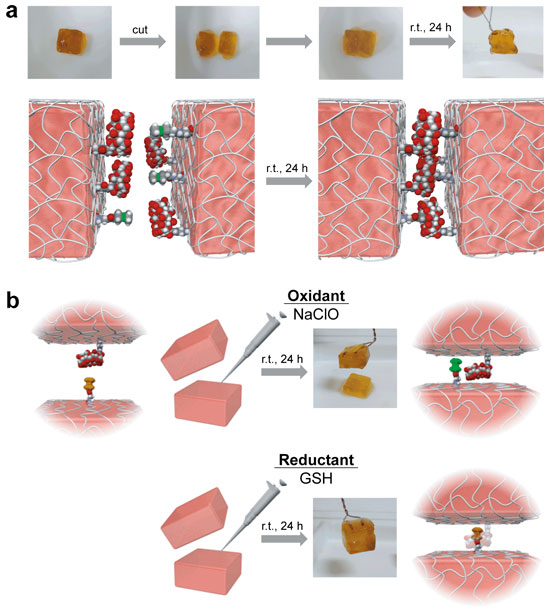
ゲルを切断し、切断面同士にて再び接合したところ、切断した際の傷が消失し、再接着が確認された(図2a)。
更に、ゲルの切断面に酸化剤を塗布し、表面のフェロセンをプラスイオン状態としたところ自己修復能の低下が確認された。続いて還元剤を塗布してフェロセン部位を中性状態に戻したところ元のように自己修復能の回復が認められた(図2b)。
 |
|
| 図2. ゲルの自己修復性と酸化還元応答性 | |
| (a) 形成したゲルの再接着試験、(b) 酸化還元の刺激を用いた自己修復性の制御実験 |
|
自己修復の機構 |
酸化還元による自己修復の制御 |
シクロデキストリンと酸化還元刺激に応答するフェロセンを導入した水溶性ポリマーを用いて、生体系に見られるような刺激に対する応答性、自己修復性を兼ね備えた材料を人工系で実現した。
(Nakahata, M.; Takashima, Y.; Yamaguchi H.; Harada, A., Nat. Commun. 2011, 2, 511.)
CD をホスト分子とする、ホスト-ゲスト相互作用を用いた自己修復材料の作製方法は、光応答性ヒドロゲルの構築、酸化還元で自己修復をコントロールに示した、(1)高分子の側鎖にホスト分子を修飾したホストポリマーと側鎖にゲスト分子を修飾したゲストポリマーを混合する方法、(2)ホスト分子修飾モノマーとゲスト分子修飾モノマーの包接錯体を架橋ユニットとして導入し重合させる方法がある。材料自身の強度が高く、材料強度の回復時間が速い高分子材料を作製するために、(2)の方法による材料作製を試みた。
β-CD 修飾モノマーとアダマンタン (Ad) 修飾モノマーの包接錯体形成後に、主鎖モノマーと共にラジカル共重合を行い、材料を形成した。形成した βCD-Adゲル(m, n) は、架橋成分の組成比が 1 mol% 未満であっても、安定したゲルを形成した (図1)。
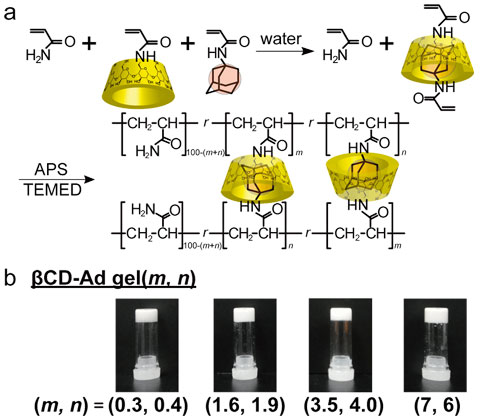
図1. βCD-Adゲルの作製とその写真。(a)βCD-Adゲルの重合スキーム。(b) 作製したヒドロゲルの写真。ホストの組成比 (m)、ゲスト組成比 (n)。
得られたヒドロゲル βCD-Adゲル(m, n) を切断し、再結合させた。再結合した数秒後には、自重を支えるほどの接着が見られた (図2a)。一方で、切断面へ競争分子 (β-CD もしくは アダマンタンカルボン酸ナトリウム) を添加すると、24 時間接着させたにも関わらず、接着しない挙動が確認された。また破断応力を測定により、応力回復率を測定した結果、24 時間後には 99 % の回復率と切断面の消失が見られた。この様な修復挙動は、包接錯体の包接-解離により発現したと考えられる (図2b)
(Kakuta, T.; Takashima, Y.; Nakahata, M.; Otsubo, M.; Yamaguchi, H.; Harada, A., Adv. Mater. 2013, 25, 2849.)
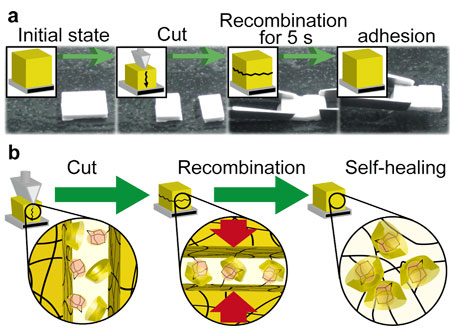 |
| 図2. βCD-Adゲルの接着挙動と接着機構。 (a) βCD-Adゲルの切断―再接着試験。(b) βCD-Adゲルの自己修復機構。 |
| 素早い自己修復挙動の発現 |
我々は超分子を用いた刺激応答性超分子材料を作製するに当たり、二つのアプローチを試みた。一つは架橋密度を変化させる方法と架橋点間距離を変化させる方法である。一方は可逆的な結合の形成と解離を利用した超分子ゲルで有るのに対し、もう一方は高分子鎖間が機械的に連結された構造であるため、トポロジカルゲルに分類される。
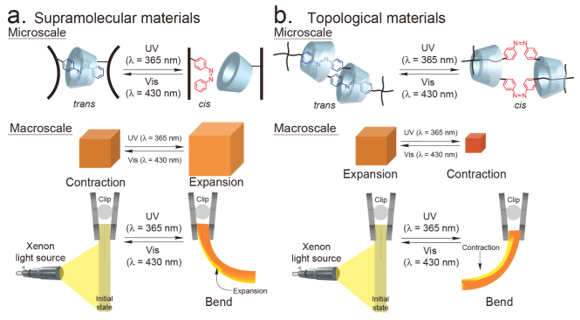
α-シクロデキストリン(αCD)とアゾベンゼン(Azo)との組み合わせにより、光刺激に応答して伸縮・屈曲するアクチュエータを構築した。このヒドロゲルに対して化学刺激、光刺激を与えることでゲル内の超分子構造を変化させ、ゲルの可逆的膨潤-収縮を実現した。ヒドロゲル内で形成された超分子架橋が光刺激応答性のホスト-ゲスト包接錯体であることに着目し、光刺激に応じた可逆的な膨潤-収縮性を検討した。αCD-Azo gel を5×5×2 mm3 に切り出し、UV光(λ= 365 nm)を1時間照射した。その結果、最大 40% の重量増大が確認された。続いて、Vis光(λ= 430 nm )を1時間照射すると、UV光照射前の重量まで戻った。光の波長に応じて超分子架橋が可逆的に形成-解離することで、ゲルが可逆的に膨潤-収縮したものと考えられる。αCD-Azo gelを平板状に成形して、UV光をαCD-Azo gelの片面に対して照射すると、大きく屈曲した。続いてVis光を照射すると、元の状態に戻り、繰り返し行えることも明らかとなった。屈曲現象が観測された原因として、光照射面のAzoが異性化することで照射面が優先的に膨潤収縮したためと考えられる。
(Takashima, Y.; Hatanaka, S.; Otsubo, M.; Nakahata, M.; Kakuta, T.; Hashidzume, A.; Yamaguchi, H.; Harada, A., Nat. Commun. 2012, 3, 1270.)
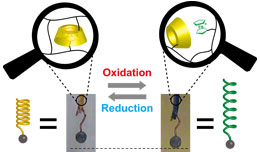
本研究では、β-シクロデキストリン (βCD) とフェロセン (Fc) との包接錯体による超分子的な架橋を導入した高分子ヒドロゲルを作製し、Fc 部位の酸化還元に応答した包接錯体の会合-解離を制御することで筋肉のように可逆的に伸縮するヒドロゲルの開発を試みた。さらに、酸化還元のエネルギーを外部に対する力学的仕事に変換する駆動素子(アクチュエータ)を作製した。
Fc 部位の酸化状態を変化させることでゲルの膨潤-収縮を制御した。還元状態の Fc はβCD と包接錯体を形成するが、Fc を酸化してフェロセニウムカチオン (Fc+) とすると βCD に包接されなくなることが知られている。βCD-Fc gel を、酸化剤(硝酸セリウム(IV)アンモニウム)の水溶液へ浸漬させたところ、ゲルは Fc に由来する橙色から Fc+ に由来する緑色へと変化し、膨潤した。ゲル内部の酸化剤を取り除いたところ、ゲルは元の橙色へと戻りサイズも元へと戻った。このような傾向は少なくとも3サイクルに渡る酸化-還元に応じて観察され、ほぼ可逆的であった。
板状に加工した βCD-Fc gel におもりを取り付けたところ、酸化-還元サイクルに応じておもりを持ち上げることができた。すなわち、ゲルは酸化還元のエネルギーを力学的エネルギーに変換し、おもりに対して力学的仕事を行えるアクチュエータとして機能していることが明らかとなった。
(Nakahata, M; Takashima, Y; Hashidzume, A.; Harada, A. Angew. Chem. Int. Ed., 2013, 52(22), 5731-5735.)
 |
本研究では、挿し違い構造である[c2]Daisy chainを架橋分子として、トポロジカルゲルを作製し、その光刺激応答性を調べた。高分子には四分岐ポリエチレングリコール(tetraPEG)を用い、αシクロデキストリン(αCD)とアゾベンゼン(Azo)からなる[c2]Daisy chainで機械的に架橋することで、ヒドロゲル([c2]AzoCD2 hydrogel)を得た。水中にて薄い平板上の[c2]AzoCD2 hydrogelに紫外光を照射すると光源方向へと屈曲した。屈曲した[c2]AzoCD2 hydrogelに可視光を照射すると元の形体へと復元した。
[c2]AzoCD2 hydrogelを凍結乾燥させた[c2]AzoCD2 xerogelの応答性を調べた。空気中で紫外光すると、[c2]AzoCD2 hydrogelよりも一万倍速く屈曲することが明らかとなった。
Iwaso, K.; Takashima, Y.; Harada, A. Nat. Chem. 2016, 8, 625-632.