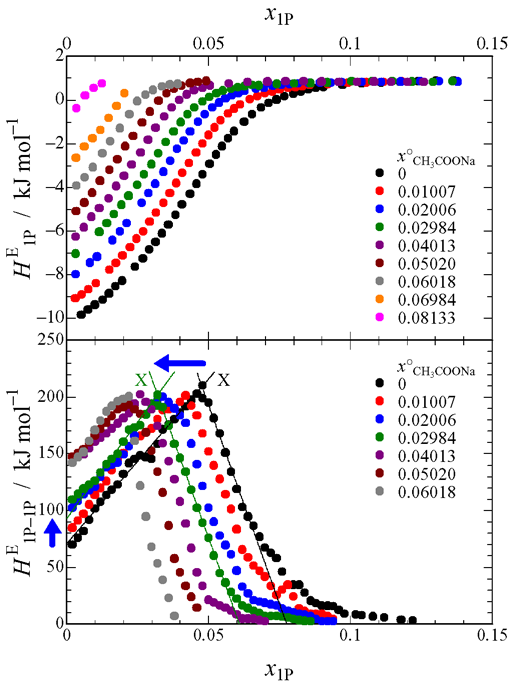
 Fig. 1 Concentration dependence of HE1P and HE1P–1P for CH3COONa.
Fig. 1 Concentration dependence of HE1P and HE1P–1P for CH3COONa.
 Fig. 1 Concentration dependence of HE1P and HE1P–1P for CH3COONa.
Fig. 1 Concentration dependence of HE1P and HE1P–1P for CH3COONa.
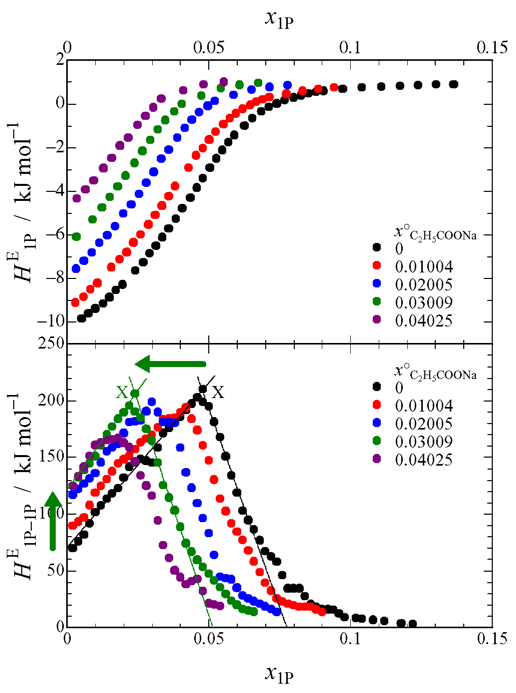 Fig. 2 Concentration dependence of HE1P and HE1P–1P for C2H5COONa.
Fig. 2 Concentration dependence of HE1P and HE1P–1P for C2H5COONa.
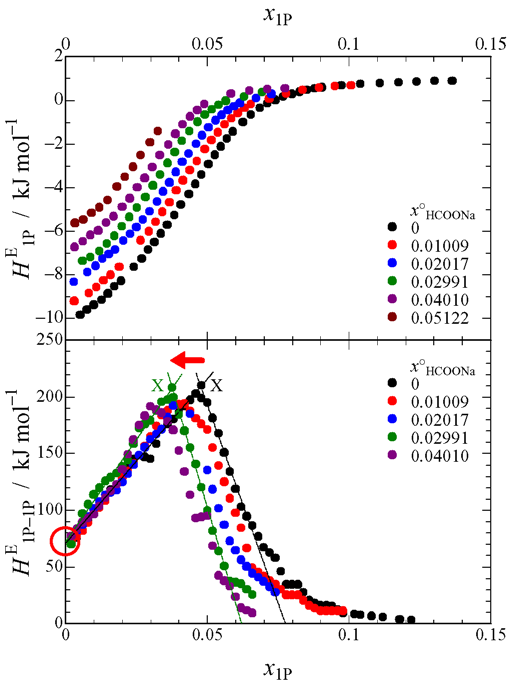 Fig. 3 Concentration dependence of HE1P and HE1P–1P for HCOONa.
Fig. 3 Concentration dependence of HE1P and HE1P–1P for HCOONa.
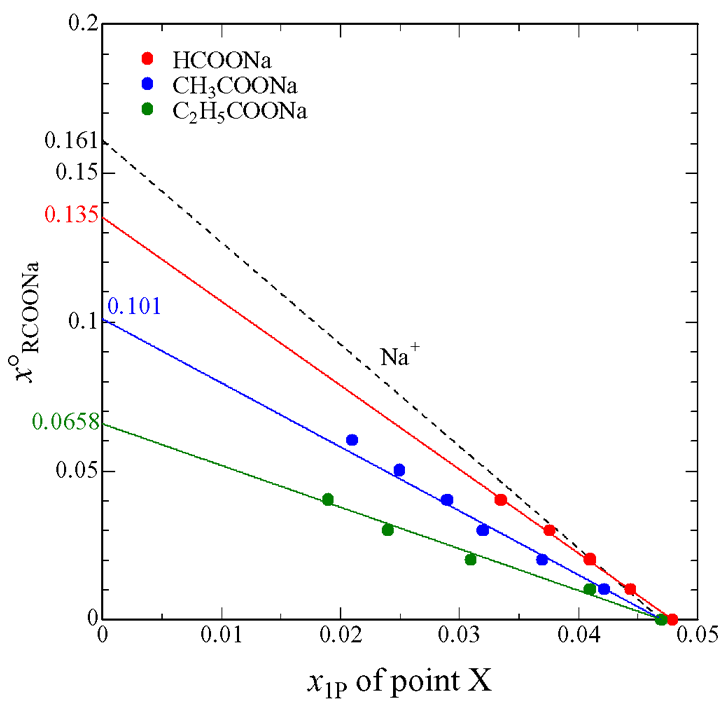 Fig. 4 Initial concentrations of aqueous solutions of sodium monocarboxylates vs. values of x1P of point X. Broken line shows the contribution of a Na+ ion.
Fig. 4 Initial concentrations of aqueous solutions of sodium monocarboxylates vs. values of x1P of point X. Broken line shows the contribution of a Na+ ion.
一般に,水溶液中の電解質溶質や非電解質溶質の挙動を調べる方法として,分光学的手法,理論計算的手法,熱力学的手法などがあげられますが,熱力学的手法の一つに,古賀によって開発された 1P-Probing 法(1P:1-プロパノール)があります(Y. Koga, Solution Thermodynamics and Its Application to Aqueous Solutions: A Differential Approach, Chapters VII and VIII, Elsevier (2007)).この方法は,1P-S-H2O(S:溶質)3成分系において 1P の過剰部分モルエンタルピー HE1P = ∂HE/∂n1P を直接測定し,その濃度微分 HE1P–1P = N(∂HE1P/∂n1P) = (1 - x1P)(∂HE1P/∂x1P) を数値的に行い,得られたHE1P–1P の 1P 濃度依存性を見ることにより,溶質の水和状態に関する情報を得るというものです.これまでに数多くの非電解質溶質といくつかの電解質溶質に対して,1P-Probing 法による研究が行われています.
現在,私たちは 1P-Probing 法によるモノカルボン酸ナトリウムの水和挙動の研究を行っており,昨年の本レポートでは,酢酸ナトリウムの測定結果について紹介しました(研究紹介記事10参照).今回は,蟻酸ナトリウムとプロピオン酸ナトリウムについて測定を行いましたので,酢酸ナトリウムの結果と併せて紹介します.
測定装置は研究室既設の Thermometric 社製等温壁型熱量計 LKB8700 を等温滴定型に改造したものを使用しました(本レポート No. 30,装置の整備記事1).Fig. 1 は酢酸ナトリウムの HE1P の測定結果と HE1P–1P の計算結果です.酢酸ナトリウム濃度の増加と共に X 点が左にシフトし,縦軸の切片も上にシフトしているのがわかります.このことは,酢酸イオンが意外にも疎水的な性質をもつことを示唆しています.Fig. 2 にプロピオン酸ナトリウムの結果を示しますが,X 点の左へのシフトや縦軸切片の上へのシフトが酢酸ナトリウムよりも大きいのが見てとれます.したがって,プロピオン酸イオンは酢酸イオンよりも疎水性が強いといえます.ところが,Fig. 3 の蟻酸ナトリウムの結果を見ますと,X 点の左へのシフトは見られるのですが,縦軸切片のシフトは見られません.つまり,蟻酸イオンがナトリウムイオンと同様,水和中心の性質をもつという驚きの結果が得られました.
Fig. 4 は各試料の X 点の横軸座標の濃度依存性をプロットしたものです.このプロットから各モノカルボン酸イオンの水和数を求めることができ,蟻酸イオン,酢酸イオン,プロピオン酸イオンの水和数がそれぞれ 1.2 個,3.7 個,9.0 個と見積もられました.
このように,3種類のモノカルボン酸ナトリウムの水和挙動についての知見を得ることができました.今後,蟻酸イオンが水和中心を示す理由やモノカルボン酸イオンの疎水性の原因として考えられる炭化水素基の効果について調べるため,炭酸ナトリウムや炭酸水素ナトリウム,また炭化水素基のより長い酪酸ナトリウムについて測定を行いたいと思います.
Y. Miyazaki, T. Kondo, A. Inaba, and Y. Koga, 6th International & 8th Japan-China Joint Symposium on Calorimetry and Thermal Analysis (CATS2011) (Hachiouji), PB13 (2011).
宮崎裕司,近藤洸生,稲葉 章,古賀精方,第47回熱測定討論会(桐生),3C1040(2011).