研究の背景 -Background-
糖とは、Fig.1.に示したような6員環の骨格に酸素原子を1つ含み、各炭素原子に水酸基が結合した環状分子で、その水酸基の結合する向き(立体配置)によって名前が付いています。代表的なものは、グルコース、ガラクトースです。また、Fig.1.の左下に表記したシアル酸(N-acetyl-neuraminic acid)は、ほとんどの糖鎖の末端(非還元末端)に結合し、細胞と細胞の接着、分化や炎症、癌化などに関与する重要な糖残基です。
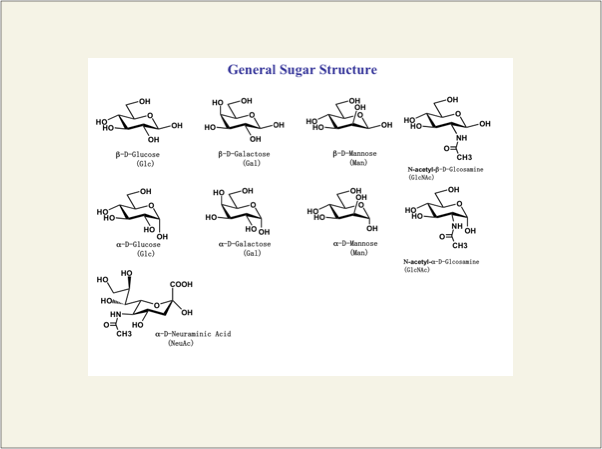
fig1
これら糖残基が鎖状に連なったものが糖鎖と呼ばれ、基本的には3つのグループに分類されます。タンパク質のアスパラギン残基の側鎖の窒素原子に結合したものをN型糖鎖と呼び、これらは、さらに高マンノース型(high mannose)、混合型 (hybrid)、複合型(complex)に分類されます。タンパク質の中のセリン、スレオニンの側鎖の水酸基に結合している糖鎖をO型糖鎖と呼びます。このO型糖鎖は、N型糖鎖に構成する糖の数はすくないものの、そのサブグループは8つに分類されています。また、炭化水素鎖が結合した糖鎖を糖脂質と呼びます。
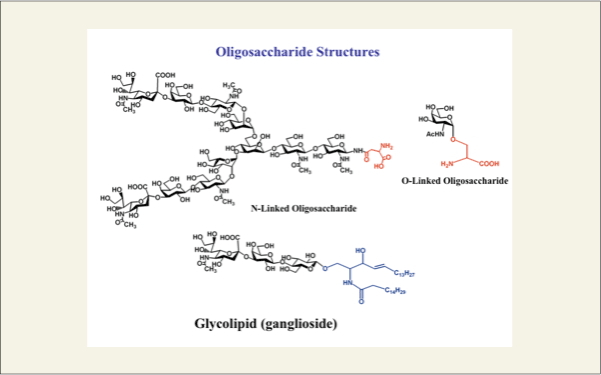
fig2
これら糖鎖は、細胞表層に存在し、細胞表層を覆うように存在しています。そしてその多くが、レセプタータンパク質と結合することで機能を発現しています。炎症時には、糖鎖が、P-、L-、E-セレクチンと結合することで白血球を炎症部位へ遊走させます。T細胞上に存在するT細胞受容体(TCR)の表層に存在するN型糖鎖は、TCRをガレクチンを介してクラスター化させ、抗原提示細胞からのMHCを介した信号を受けることを効率化しています。また、B細胞上のα2,6-シアリル糖鎖は、抗体の産生に関与していることが報告されています。一方、Fig.3のように細胞表層の糖鎖は、コレラ、インフルエンザ等が細胞に侵入する際リガンドとして働くことが知られています。ウイルス等がヒト細胞上の糖鎖を認識し接着することが、感染の第一ステップになります。
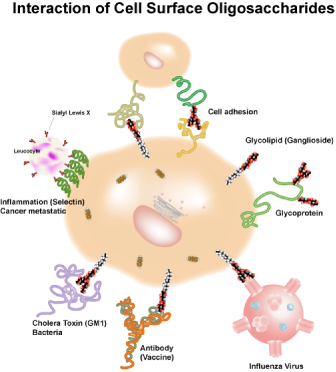
fig3
糖鎖は、細胞内で構築されます。糖残基と糖残基が結合する反応は、糖転移酵素により行われます。糖がリン酸化された糖ヌクレオチドと糖を受け取る受容体糖鎖が、糖転移酵素の触媒部位に取り込まれ、糖ヌクレオチドから糖残基が受容体糖鎖へ転移します。この反応が繰り返しおこなわれ、糖鎖が構築されます。この糖転移酵素は、転移させる糖の種類に相当するだけ細胞内に用意されています。糖残基と糖残基の間の結合様式は、理論的には、8通り考えられます。非還元末端側の1位の立体配置がα、βの2通りと、還元末端側の糖水酸基が4つあるので、組み合わせ的に8つとなります。生体内の糖残基と糖残基の結合様式は、この8通り全てを構築するわけではありませんが、糖鎖の長さ(構成する糖残基の数)が増えるにしたがって、その構造的な多様性は増加します。
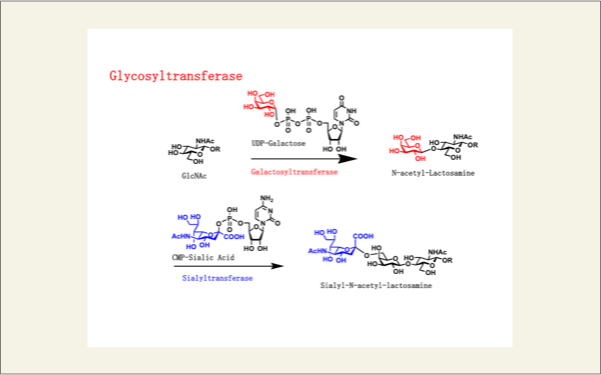
fig4
また、生体内では糖残基を加水分解する酵素が用意されています。すなわち、非還元末端の糖残基を除去するexo型糖加水分解酵素です。この酵素も、生体内に存在する糖残基の形に対応して用意されています。このexo型の酵素は、糖鎖の非還元末端に存在する糖残基のみを除去し、糖鎖の中に組み込まれている糖残基は除去しません。この場合は、endo型という酵素によって除去されています。
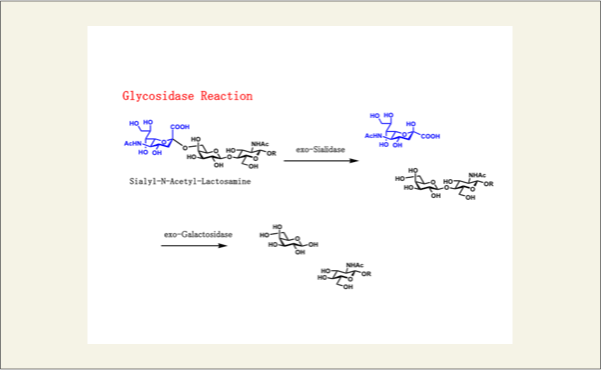
fig5
近年、糖鎖の機能は詳細に調べられて来ましたが、ヒトのABO式血液型を決めているのが糖鎖構造であるということは、広く知られています。ヒトは、H抗原(血液型はO型)に相当する糖鎖(フコシルα1,2-ガラクトース)をもともと持っています。A型の血液型をしているヒトは、このH型糖鎖のガラクトースの3位に、N-アセチルガラクトサミン残基が結合しています。また、B型のヒトは、同じ位置にガラクトース残基が結合しています。AB型の場合は、H、A、B全ての糖鎖構造が共存しています。これら血液型の抗原決定基を合成するのは、前述の糖転移酵素です。遺伝子でどの酵素を持つかが決まっています。分子の構造では、AとB型の違いは窒素原子を含むNアセチル基か、酸素を含む水酸基の違いですが、それらを構築する酵素のアミノ酸は配列は数残基の違いでしかありません。また血液型抗原決定基を合成する酵素のX線解析がおこなわれており、生体がどのように、血液型抗原決定基を構築しているか議論されています。
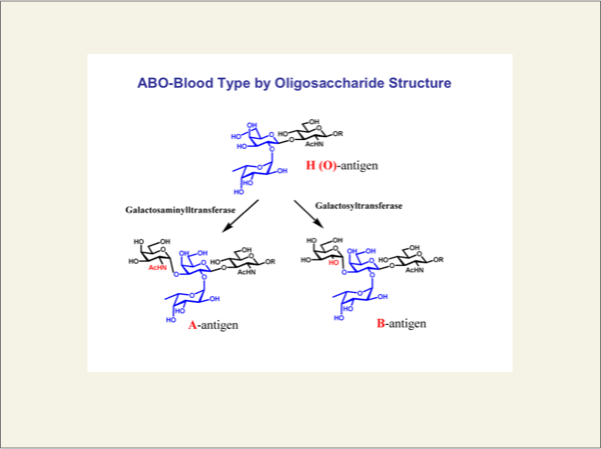
fig6
糖タンパク質の表層は、糖鎖が数本結合しています。そしてその非還元末端にシアル酸が存在すると、糖タンパク質の血中での寿命が遅延することが明らかにされています。シアル酸が結合していない場合は、その非還元末端がガラクトース残基となり、その糖タンパク質は肝臓のガラクトース結合レクチンに取り込まれ代謝されるか、腎臓の膜を通って代謝されます。しかし、その糖鎖構造が2よりは3、4と分岐度が多くなり、そしてシアル酸が結合すると代謝の遅延効果が増加するため、近年糖タンパク質製剤の開発に利用されています。そのなかでも成功した例は、貧血治療薬であるエリスロポエチンです。
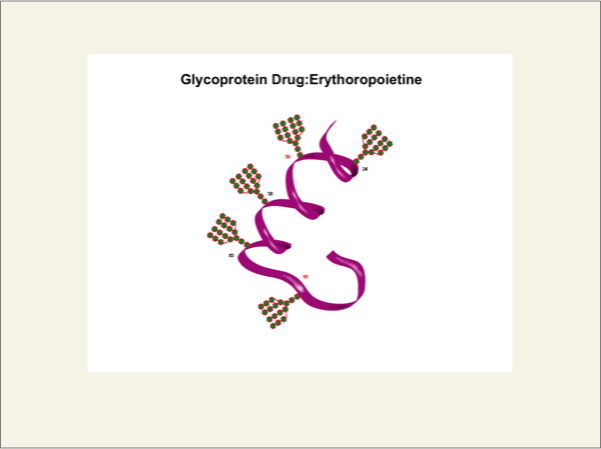
fig7
近年、ヒト型抗体がxenoマウスを用いて調製することができるようになり、癌抗原などを標的とした抗体医療が進歩してきました。この場合、抗体のFc部分に結合している複合型糖鎖の存在が、ADCC活性を引き起こすために必要です。その際、糖鎖の非還元末端に結合しているフコースを除去するとそのADCC活性が向上することが見出されており、糖鎖の機能に注目が集まっています。ヒト型抗体は、動物細胞で培養され調製されるようになり、近年では、細胞へ導入される信号のブロックやアゴニスト、アンタゴニスト活性が期待され治療薬として利用されています。Fc部分の糖鎖は、タンパク質の3次元構造を維持するために重要であるとも考えられています。IgG、IgAのFc部分とそのFcレセプターが結合した状態のX線解析は報告されており、どのように複合体が形成されているかが明らかになっています。
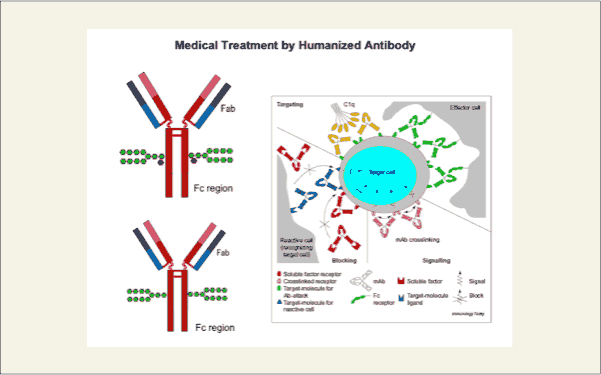
fig8
糖鎖はヒトエイズウイルス(HIV)にも重要な役割を果たしています。HIVは、ヒトのマクロファージに感染する際、HIV上のGP120というタンパク質とマクロファージ上のCD4が結合することでGP120の構造が変化し、V3ループと名づけられたペプチド鎖が表面にでてきて、マクロファージ上のケモカインレセプター(CCR5)と結合することで最初の接着が完了します。そして、細胞内へ侵入し感染します。しかし、HIVはヒトの免疫機構から逃れ、ヒトの細胞内に潜伏することができます。これは、HIV上のGP120表面がヒト型糖鎖(ハイマンノース、複合型糖鎖)で覆われ、これを隠れ蓑にしているといわれています。このことからも、ヒト型糖鎖は、血液型糖鎖と同様、自己を免疫に表現する分子であるといえます。最近では、このHIVのハイマンノース2本を同時に特異的に認識する抗体が見出され、HIVの治療薬(ワクチン)としての可能性が検討されています。

fig9 SCIENCE発表紙より
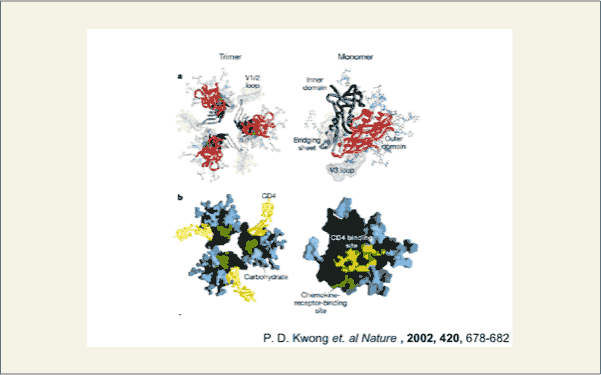
fig10
炎症時には、白血球上のシアリルルイスXという糖鎖が、セレクチンと呼ばれるレクチンに特異的に結合することで白血球を炎症部位へ遊走させます。セレクチンには、P-セレクチン、 L-セレクチン、 E-セレクチンと3種類あります。

fig10
インフルエンザウイルス表層には、シアリル糖鎖を認識し結合するレクチンであるヘマグルチニンと、シアリル結合を加水分解するシアリダーゼが存在します。インフルエンザウイルスは、まず、ヘマグルチニンをつかって、ヒト細胞上のシアリル糖鎖に接着後、膜融合することでウイルスのもつRNAをヒト細胞内に導入します。そして、複製後、ヒト細胞から発芽する際、ウイルス表層のヘマグルチニンに結合した糖鎖末端のシアル酸(ヘマグルチニンをヒトの細胞内で複製する際、シアル酸も組み込まれている)をヘマグルチニンが互いに認識し、結合することで1つ1つのウイルス粒子に分かれて発芽することができないといわれています。この際ウイルスは、シアル酸と糖鎖の間の結合を加水分解するシアリダーゼを用いて、ヘマグルチニン上のシアリル糖鎖を分解し、ウイルス同士が離れ発芽しているようです。ウイルスは、このように巧みな手法を用いてヒトに感染する方法を得ています。
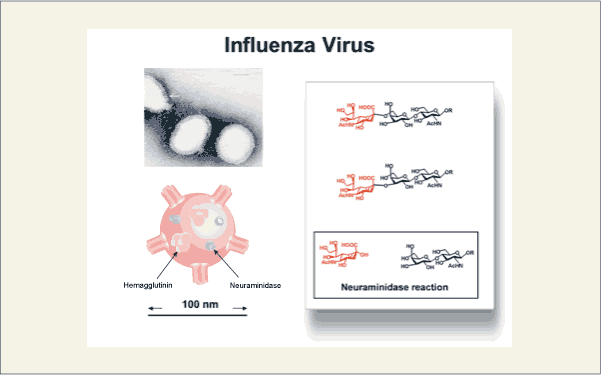
fig12
このように、糖鎖が関与する生命現象の幾つかは、タンパク質に結合した糖鎖です。しかし、この糖鎖には構造的な不均一性があります。タンパク質のアミノ酸配列が同じでも結合している糖鎖の構造が違います。これをグリコフォームと呼んでいます。
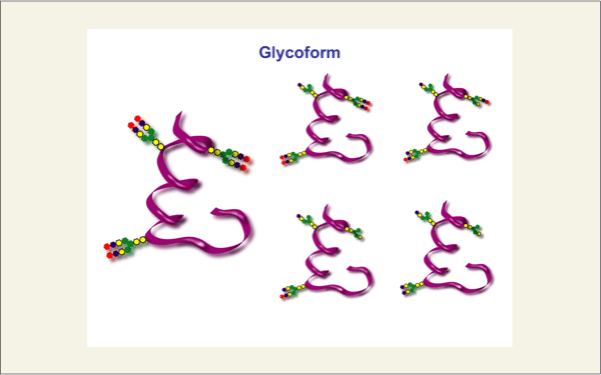
fig13
なぜ、このようなグリコフォームが存在するのか未だ、その理由は明らかにされていません。また、グリコフォームの中のどの糖鎖が生命現象に絡んでいるのかも明らかにされていません。糖タンパク質を動物細胞や、昆虫細胞に感染するウイルスを使って発現することはできますが、この際も必ず、グリコフォームを発現しており、純度のよい糖鎖を持つタンパク質を手にいれることは不可能な状態です。そこで、梶原研究室では、純度の良い糖鎖をもつ糖タンパク質、糖ペプチドの合成を検討しています。
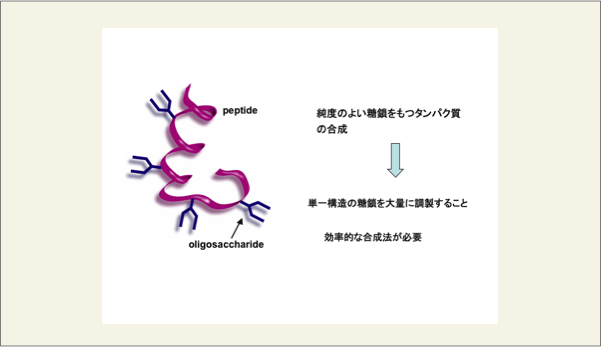
fig14















