研究成果 -Reserch-
複合型糖鎖ライブラリーの合成
当研究室では、以下の方法により、複合型糖鎖を合成し、ライブラリーを作成しました。
タンパク質上に存在する糖鎖は、アスパラギンの側鎖のアミド基がNグリコシル化されたN型糖鎖と、セリン、スレオニンの側鎖のアルコールがグリコシル化されたO型糖鎖に分類できます。この糖鎖の機能を解明するためには、高純度の糖鎖を合成することが必要ですが、化学的に調製するには非常に高度な技術が要求されます。一方、糖鎖を酵素により調製するには、糖転移酵素および糖加水分解酵素の逆反応を用いて行う方法があります。糖転移酵素は、糖供与体である糖ヌクレオチドから糖残基を相当する糖鎖受容体に転移させることで糖鎖を構築することができます。糖加水分解酵素は、糖残基と糖残基の間のグリコシル結合を切断することができます。いままで、大型N型糖鎖を、グラムスケールで調製することは非常に困難でしたが、鶏卵には、複合型糖鎖が比較的高純度で含まれていることが知られていました(Fig. 1)。
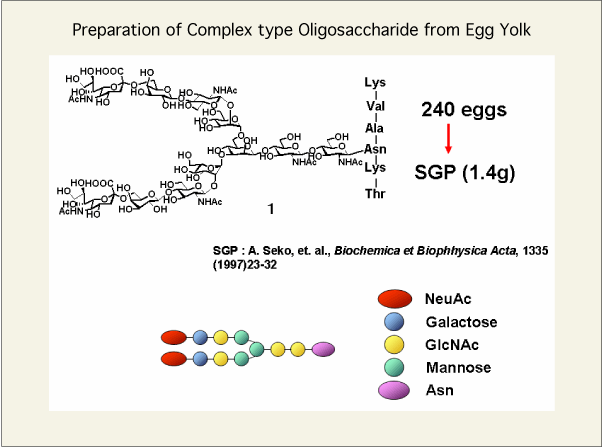
fig1
そこで当研究室では、この鶏卵の複合型糖鎖を糖加水分解酵素で逆に糖残基を順次除去して、様々な構造の糖鎖に任意に変換できれば、容易にN型糖鎖誘導体を大量に得ることができると考えました。糖の形は、Fig.1の右下に示したようなシンボルで表しています。糖鎖誘導体を調製するルートは具体的には、この2分岐ジシアリル糖鎖1から、一方の分岐鎖のみシアル酸の結合していない糖鎖2を調製し、そしてそのアシアロ分岐鎖を、エキソ型の糖加水分解酵素で順次処理(2→3→4→5→6)していけば、任意に糖鎖構造を変換できると考えました(Fig. 2)。
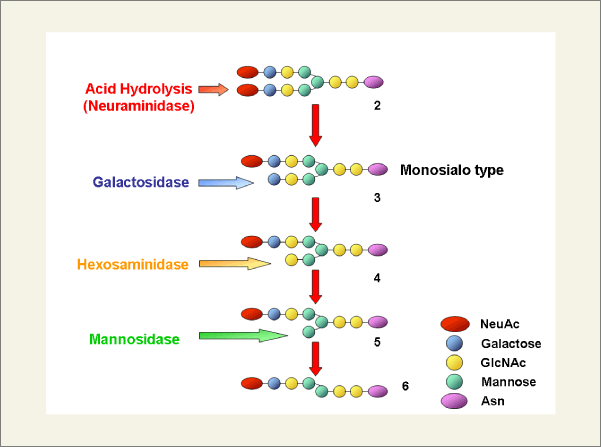
fig2
まず、文献に従って卵黄よりシアリルグリコペプチド(SGP)を単離しました(Fig. 1)。しかし、このSGPは、6つのアミノ酸からなるペプチドを有しているので、アスパラギン残基を残して全てのアミノ酸をぺプチダーゼ(プロナーゼ)で消化し、そして、糖鎖1の非還元末端のシアル酸を弱酸で処理し、モノシアリル糖鎖2へと変換しました(Fig.2)。しかし、この反応では、モノシアリル糖鎖とアシアロ糖鎖の混合物(3、4、5)を得ました。糖加水分解酵素を用いて一方の分岐鎖のみ任意に除去する操作をするには、これら糖鎖の混合物を分離する必要がありました。しかし、高速液体クロマトグラフィー(HPLC)を用いてもその分離は非常に困難で、これは、糖鎖分子の極性が高いために、糖鎖の異性体間での疎水性に差がないためHPLC(逆相カラム)での分離が困難であったと考えられます。そこで、糖鎖に疎水性の高い官能基を結合させて分離することを検討することにしました。その結果、糖鎖の還元末端に結合したアスパャMン残基にはFmoc基を、シアル酸のカルボキシル基にはベンジルエステル基を選択的に導入することでこれらモノシアリル糖鎖(3、4、5)をHPLCで分離することに成功しました(Fig.3)。
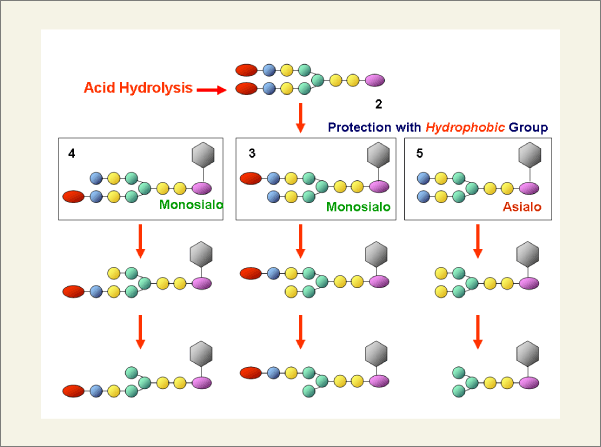
fig3
また、アシアロ分岐鎖の非還元末端に位置するガラクトース残基をβ-ガラクトース加水分解酵素で除去すると、更にそれら両異性体が良好にHPLCで分離できるようになり、グラムスケールでの糖鎖誘導体の調製が可能となりました。続いて、単離したモノシアリル糖鎖に対して、順次エキソ-型の糖加水分解酵素(β-ガラクトシダーゼ、β?D-グルコサミニダーゼ、α-マンノシダーゼ、α-シアリダーゼ)を作用させ、以下の図には、得られた糖鎖の1部を示してありますが、このような糖鎖を24種類容易に得ることに成功しました。
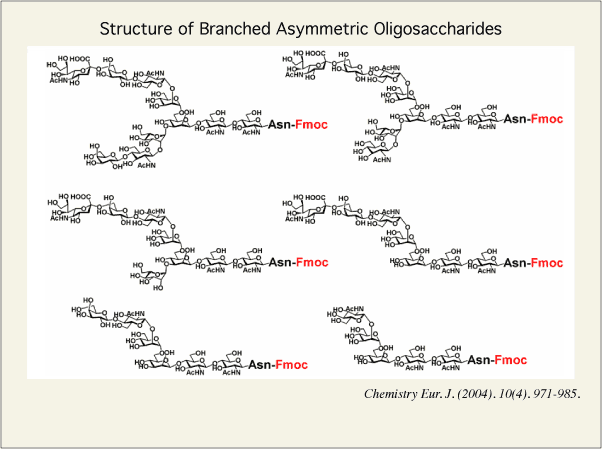
fig4
また、これら糖鎖はその非還元末端にシアル酸が結合していますが、その結合様式は、ガラクトースの6位へのα2,6結合です。天然に存在するシアル酸は、この他にガラクトースの3位に結合したものが多数存在するので、2分岐糖鎖の両非還元末端がガラクトースの糖鎖に対し、α-2,3-シアル酸転移酵素を用いて、α-2,3結合のシアル酸を有するモノシアリル糖鎖を調製することも検討しました。用いた酵素は、バクテリア由来で、アシアロ糖鎖5にシアル酸を転移させることができました。そこで、モノシアリル糖鎖2種類が最も得られる段階で酵素反応を終了し、それぞれHPLCで分離し、そして、アシアロ分岐鎖に対して、糖加水分解酵素を順次作用させて同様に糖鎖構造を改変しました。以上述べた糖加水分解酵素による反応は、市販の酵素が十分利用でき、100mgスケールの反応を12時間程度で処理することができます。得られた糖鎖は、すべて1H NMRを測定し、Vliegenthart らのNMRデータであるリポーターグループと比較して決定しました。また、原料となるジシアリル糖鎖は、任意の糖残基をスペクトル処理により抽出して解析する新規なNMR測定法を開発して完全解析をしております。
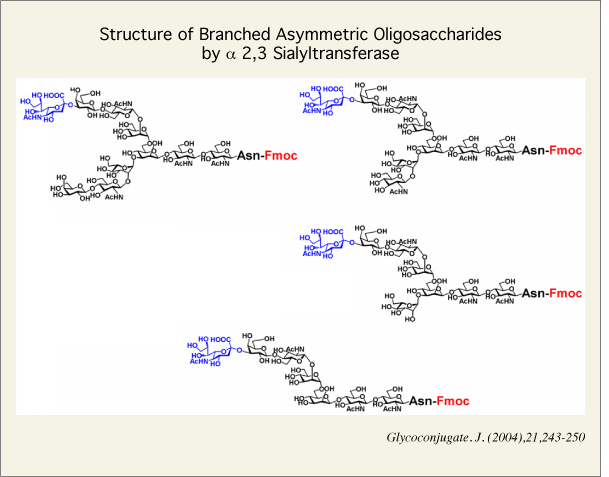
fig5






